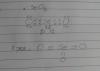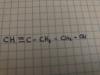-
a) ACIDO 2 BUTENOICO
B) PROPANOAMIDA
C)METILPROPANOAMINA
D)2-HEXANONA
E)1,4 BUTANOL
F)ETILMETILETER
G)2,3,4- HEPTATRIOL
H) 1,4 DIBROMOBENCENO
I)
J)
5.
a)función
b) posición
c)
d) de cadena
e)
Corregirmelo porfavor Urgente
-
Hola Unicoos
Ya me he visto el vídeo de Breaking (muchas gracias Breaking) y lo he entendido todo, pero ahora me resulta difícil hacerlo yo, es decir, que me den un compuesto y yo tenga que oxidarlo o reducirlo como en este caso. Hay algún truco?
Si siempre pones un OH siempre se reduce? Y para oxidarlo habría que quitar un OH entonces?
Dadme algún truco porfa, en selectividad suelen caer de este tipo.
Muchísimas gracias
-
Como seria la hidrogenación del 1,2-diestearo-3-oleato de glicerilo ? pueden ayudarme?
-
Hola, alguien me puede ayudar con este ejercicio?. Sobretodo con el apartado a), muchas gracias.
Se dispone de 500 mL de una disolución acuosa de ácido sulfúrico 10 M y densidad 1,53 g/mL.
a) Calcule el volumen que se debe tomar de este ácido para preparar 100 mL de una disolución acuosa de ácido sulfúrico 1,5 M.
b) Exprese la concentración de la disolución inicial en tanto por ciento en masa y en fracción molar del soluto.
-
Hola unicoos,
sé de reacciones de adición, eliminación, sustitución, esterificación, etc..... No me suena haber visto " en condiciones reductoras". Alguien me puede decir de qué tipo es esta reacción o enviarme un enlace o algo para ver cuáles son y cómo se hacen?
Muchas gracias


Breaking Vlad
el 10/5/19Hola lbp,
tenemos este vídeo explicando los estados de oxidacion dentro de las moléculas orgánicas:
Estados de oxidación en química orgánicaEl concepto de reducción en química orgánica es el mismo, recibir electrones y disminuir tu estado de oxidación. En ese caso tenemos un aldehido (oxidado) y al añadirle un reductor, bajamos su estado de oxidación, por lo que se trata de una reducción.
Es análogo a reducir por ejemplo Mn7+ a Mn2+, pero con carbonos.
Un saludo,
Breaking Vlad
-
Plantee el ejercicio de la siguiente manera:
CO(g) + Cl2(g) <=====> COCl2(g)
I(mol): ____ ____ 0.03
Eq(mol): x x 0.03 - x
MolCO(eq)= X = Pco(eq)*V/R*T = (0.0497)(1.5)/((0.0821)(800)) =0.01135
0.03 - 0.01135 = 0.0189
MolarCO = 0.0.1135/1.5= 0.00757=7.57x10-3
Molar COCl2= 0.0189/1.5 = 0.0124
Eq(Molar) 7.57x10-3 7.57x10-3 0.0124
Kc = (COCl2)/(CO)(Cl2) = (0.0124)/((7.57x10-3)*(7.57x10-3)) = 216.97
Kp = Kc*(RT)^n =216.97*(0.0821*800)^-1 = 3.3
Esta correcto mi razonamiento?
-


Breaking Vlad
el 9/5/19Hola Carmela,
efectivamente estás en lo correcto, aunque está incompleto.
Al mezclar las dos sales se produce la reacción que dices, perfectamente formulada y ajustada, genial:
Na2C2O4 + CaCl2 -> CaC2O4 + 2NaCl
Y a posteriori el oxalato de calcio entra en equilibrio de solubilidad:
CaC2O4 <-> Ca2+ + C2O42-
Y con eso ya haces el equilibrio de solubilidad.
Un saludo,
Breaking Vlad