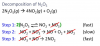-
En general, podemos afirmar lo siguiente (respecto a los puntos de fusión/ebullición de las sustancias químicas):
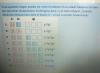
Gases nobles < Fuerzas de London < Fuerzas Van der Waals < Puentes de Hidrógeno < Enlace covalente < Enlace iónico < Enlace metálico
Lo digo para preguntas como la siguiente. Ordene, de menor a mayor, según los puntos de fusión: Xenón, Neón, NaCl, NH3, Fe, CH3CH2CH2COOH, CCl4
Yo lo pondría así: Xenón < Neón < CCl4 < NH3 < CH3CH2CH2COOH < NaCl < Fe
¿Es una buena estrategia o estoy equivocado? Muchas gracias.
Usuario eliminado
el 30/1/19Buenas, en primer lugar, agradecer su labor en este foro. Que el punto de fusión del neón sea menor que el del xenón lo entiendo, pues la masa atómica del xenón es superior a la del neón. Lo que no entiendo es la razón por la que el punto de fusión de CCl4 es superior a la del NH3? Los puentes de hidrógeno no son más fuertes que las interacciones de dispersión, o de London?
-
Tengo problemas para sacar la x :
En un recipiente cerrado de 1L, en el que se hizo previamente el vacío , contiene 1,998 gramos de yodo( sólido), Seguidamente , se calienta hasta alcanzar una temperatura de 1200ºC.La presión en ell interior es de 1,33 atm . En estas condiciones , todo el yodo se encuentra en estado gaseoso y parcialmente disociado en átomos : I2(g)-2Ig)
a) Calcula el grado de disociación del iodo molecular
b)Calcula las constantes de equlibrio Kc y Kp para la susodicha reacción a 1200ºC
-
Estimado Breaking Vlad, muchas gracias por tú amable y clara respuesta, sin abusar de tu amabilidad, quisiera saber de dónde podemos extraer y documentar esta información que me has brindado. Desde ya muchas gracias por tu atención. Adrián. Te escribo por aqui pues no he encontrado como hacerlo de otra forma. Gracias.
Breaking Vlad
hace 14 horas, 23 minutosHola Adrián.
Imagínate que en esa medida hubiera 3g de acohol. Si te bebes solo esa medida, introducirár 3g de alcohol en tu cuerpo.
Si esa misma medida la diluyes en 3 de agua, y luego te lo bebes todo, estarás metiendo igualmente 3g de alcohol en tu cuerpo. Con lo que la cantidad es la misma.
La única diferencia es que estás introduciendo más agua, y orinarás más, pero el alcohol en sangre es el mismo.
Un saludo,
Breaking Vlad


Breaking Vlad
el 30/1/19Hola Adrián,
puedes contactar conmigo a través de la plataforma, o redes sociales sin ningún problema.
Sinceramente no he utilizado referencias sino más bien sentido común. Basándome en el concepto de disolución:
Porcentaje volumen - volumen (%v/v)
Y también en el concepto de que la conservación de la materia. Si introduces x g de sustancia en un sistema, esos x g estarán dentro, y en el caso del cuerpo humano, van a la sangre.
Un saludo,
Breaking Vlad
-
Hola!
Tengo una duda con un ejercicio en el que me pide calcular el cambio de la entropia y la entalpia para un proceso adiabatico, que va de el estado 1 al estado 2. Me da los siguientes datos:
Para el estado 1: N=0.5mol T=244K P=1atm y V=10L
Para el estado 2: N=0.5mol T=386,7K P=3,17atm y V=5L
En general tengo muchas dudas cuando tengo un proceso adiabatico. Que cosas tengo que tener en cuenta para este tipo de procesos?
Muchas gracias!
-
Buenos días a todos.
Tengo una consulta con éste ejercicio:

Se como se comportan los gráficos pero más que relacionarlos visualmente, como que los dos son crecientes, no sabría apreciar una buena relación para complementar la respuesta. ¿Hay alguna relación importante que tenga que saber sobre éstos gráficos?
Muchas gracias por el tiempo.
-
Se hace reaccionar dióxido de manganeso y ácido clorhídrico para obtener gas cloro según la reacción:
MnO2 (s) + HCl (ac) → MnCl2 (s) + H2O (g) + Cl2 (g)
Determine: a) La cantidad en gramos de MnO2 necesaria para obtener 100 L de Cl2 a 20o C y 1 atm.
b) El volumen de ácido clorhídrico 5 M necesario.
Masas atómicas: M(Mn) = 54,9; M(O) = 16,0. R = 0,082 atm l mol-1 K-1


Jerónimo
el 29/1/19MnO2 (s) + 4HCl (ac) → MnCl2 (s) + 2H2O (g) + Cl2 (g)
Calculamos los moles de Cl2 obtenidos n=PV/RT =(1*100)/(0,082*293) =4,16 moles de Cl2
4,16 moles Cl2 x 1molMnO2/1molCl2 x 87g/1molMnO2 = 362 g de MnO2
b) 4,16 moles Cl2 x 4moles HCl/1mol Cl2= 16,64 moles de HCl
M=n/V V=n/M=16,64/5=3,3 l
-
Buenas tardes.
Conversando con mi amigo nos surgió una duda, el me dice que tomando una medida de whisky con tres o cuatro más medidas de agua en la misma copa, disminuye la cantidad de alcohol que iría a la sangre, que variaría la cantidad de ingesta de alcohol, que se diluye de alguna forma, hasta varia su graduación alcohólica en alguna medida.
En cambio yo le he dicho que simplemente es la misma cantidad de alcohol que se ingiere y que va a la sangre. Que puede su sabor ser más suave o diluido pero que la ingesta de alcohol seria la misma. Que en caso de un control de alcoholemia podría darle positivo.
Lo que deseamos saber con exactitud es: si tomando una medida de whisky más tres o cuatro medidas de agua en el mismo recipiente, disminuye la cantidad de alcohol que va a la sangre o simplemente es la misma cantidad. Muchísimas gracias por su atención y sepan disculpar la molestia.


Breaking Vlad
el 29/1/19Hola Adrián.
Imagínate que en esa medida hubiera 3g de acohol. Si te bebes solo esa medida, introducirár 3g de alcohol en tu cuerpo.
Si esa misma medida la diluyes en 3 de agua, y luego te lo bebes todo, estarás metiendo igualmente 3g de alcohol en tu cuerpo. Con lo que la cantidad es la misma.
La única diferencia es que estás introduciendo más agua, y orinarás más, pero el alcohol en sangre es el mismo.
Un saludo,
Breaking Vlad
-
Buenas tardes me he quedado atascado en este ejercicio no entiendo como seguir podrían explicarme que tengo que hacer para seguir.
Gracias de antemano


joshua Perez Peña
el 28/1/19Gracias creo que ya lo resolví . Me podrían decir si el concepto de reacción endotérmica esta bien explicado, aunque el valor de Kp este en negativo si la temperatura sube y el valor de Kp aumenta, la reacción genera mas producto por lo que es endotérmica no?
Gracias por la colaboración es de gran ayuda.
Saludos
-
Buenas tardes, tengo una consulta sobre un ejercicio en concreto de cinética química referido a los mecanismo de reacción.
"Para la reacción en fase gaseosa 2 N2O3 → 4NO2 + O2 , se propuso el siguiente mecanismo:
1) N2O5 ↔ NO2 + NO3 (Equilibrio rápido)
2) NO2 + NO3 → NO2 + O2 + NO (Lenta)
3) NO + NO3 → 2NO2 (Rápida)
En base al mismo, indique la ley de velocidad y el orden de reacción.
Mi problema es que al sumar todos los pasos elementales, no me da la reacción global que me dieron al principio del ejercicio. Eso me parece raro.
Por otro lado sé que la reacción lenta es la determinante en la ley de velocidad y si en ella se encuentra la concentración de un intermediario, debo sustituirlo igualando las leyes de velocidades del equilibrio rápido y despejando dicho intermediario.
¿Cuál sería la ley de velocidad de ésta reacción? En ejercicios similares no tengo problema, pero me tope con algo así y no se cómo proseguir.
Muchas gracias por su tiempo!
Edición: Dandole vueltas llego a la conclusión de que el inciso del problema tiene un error al redactar la reacción global... El reactivo debería ser N2O5 y todo quedaría correctamente.