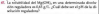-
a)
BaSO4 <===> Ba+2 + SO4-2
SO4-2 + H2O <===> HSO4- + OH-
BaSO4 + H2O <===> HSO4- + OH- + Ba+2
b)
PbCl2 <===> Pb+2 +2Cl-
c)
Fe(OH)3 <===> Fe+3 + 3OH-
d)
CaCO3 <===> Ca+2 + CO3-2
CO3-2 + H2O <===> HCO3- + OH-
CaCO3 + H2O <====> HCO3- + Ca+2 + OH-
En el libro las respuestas correcta son la c y la d pero no se el razonamiento con el que llega a esas respuesta
Yo habría descartado la c porque al estar en una solución ácida se incremente aunque sea un poco la cantidad de OH- que por efecto del ion común reduciría su solubilidad, pero por lo visto mi razonamiento esincorrecto


Breaking Vlad
el 9/7/19Hola Ángel,
efectivamente son la c) y la d)
Piensa que en el agua neutra tienes un pH=7, lo que quiere decir que tienes 10-7 M de OH-
En una disolución ácida, la [H+] aumenta, y la [OH-] disminuya (por ejemplo: pH=1 --> [H+] =10-1 M, y [OH-]=10-13M)
es decir, en una disolución ácido la concentración de OH- no aumenta ni un poquito, de hecho baja con respecto al agua neutra.
Un saludo,
Vlad
-
La respuesta del ejercicio da pH=9.6
Me dicen que la solubilidad es 0.65 g/ls = (0.65g/l)*(1mol/58.3g)= 0.01115 mol/l
Se que la disolución reguladora me da una concentración inicial de OH que llamare Co
Mg(OH)2 <====> Mg+2 + 2OH-s Co - 2s
Kps= (Mg+2)*((OH-)^2)=1.8x10-11
Kps= s((Co+2^ 2) = Co^2 +4Co*s 4*(s^2) = 1.8x10-11/s
Después de despejar y sustituir s por su valor me da que
Co^2 + 0.446Co +4.9728x10-4=0
Co= (-0.0446 +- 2x10-4)/2
Co1= -0.0444 M
Co2= -0.0448 M
Como puede observar los valores de Co son negativos y creo que se debe a que la solubilidad que me da el ejercicio no es correcta pues es muy alta:Mg(OH)2 <====> Mg+2 + 2OH-
s 2s
Kps= 1.8x10-11 =4*(s^3) => s= 0.0001651 M
La solubilidad normal es mas baja que la solubilidad que me da el ejercicio cuando debería ser lo contrario por el efecto del Ion común pues el búfer aunque sea muy poco aporta OH-
Me pueden decir si mi razonamiento es correcto?
-
Buenos días!
Se que no respondéis a dudas universitarias, pero quizás tenga suerte y alguien me sepa solucionar este problema que llevo días intentando solucionar. Se trata de hacer un análisis retrosintético.
Si alguien tiene alguna idea, le agradecería mucho su ayuda.
Muchas gracias de antemano!
-
La muestra se preparó homogeneizando 4,14 g de pescado con 50 ml de bicarbonato de calcio a 2000 rpm durante 6 minutos. Se centrifugó y luego se tomó una alícuota de 0,03ml donde se encontraban las proteínas en una dilución 1:4.
Mi duda es sobre el rendimiento lo demás está bien supuestamente. (Los mg de proteína contenidos en los 0,03ml fueron obtenidos a partir de la curva de absorbancia).
Desde ya muchas gracias



Breaking Vlad
el 1/7/19Hola,
parece que se te ha olvidado multiplicar por los 50 mL
el pescado lo has tratado en 50 mL de disolucion. y esos 50 mL tienen concentración 7.832 mg/mL. De ahí puedes sacar las proteinas totales.
Y con eso podrás saber el total de proteinas que había en esos 4,14g de pescado.
Un saludo!
-
hola a todos...alguien sabe la razon de que en formula por ejemplo..potasio K se postule con un atomo solo K y el litio li2 que es del mismo grupo se postule li2 el el N tambien se postule N2....cual es la razon o teoria sobre esto?. gracias.
-
Buenas!! A quien se debe el sistema periódico actual a Alfred Werner o a Horace Deming?? En cada sitio encuentro una cosa, la propuesta de Demin era de 1923 fecha en la que Werner ya había muerto, por lo que obviamente la ultima versión es la de Deming, pero cual es la contribución de cada uno?