-
Qué significa que la variación de la entropía (S) de un proceso es igual y de signo contrario a la variación de la S del proceso inverso? Gracias.
-
Como puede uno estar seguro de los estados de oxidación cuando una tabla periódica dice una cosa y en otra indica otra.?
-
Se disuelven 37,75 g de hipoclorito de calcio en agua hasta tener 500 mL de disolución. Cuando se alcanza el equilibrio, la sal presenta un grado de hidrólisis de 1 · 10−3. Calcula el 𝑝H de la disolución y la 𝐾𝑎 del ácido hipocloroso.


Breaking Vlad
el 15/4/19Hola Elena,
se trata de que los ejercicios los intentéis vosotros mismos y nos preguntéis las dudas concretas que os salgan durante el procedimiento.
Te recomiendo este vídeo:
un saludo,
Breaking Vlad


Jerónimo
el 16/4/19A mi si me da ese resultado. Te lo paso por si es un problema de concepto o de cálculo.
En Unicoos intentamos resolver dudas y es mejor que la próxima vez plantees todo el procedimiento para poder corregirlo.
37,75g Ca(ClO)2 x 1mol/143g x 1/0,5 l =0,528 M
Ca(ClO)2----------→ Ca+2 +2ClO-
ClO- +H2O ←----------→HClO +OH- Kh=cα²/(1-α) = 2x0,528(1.10-3)²/(1-1.10-3) =1,057.10-6 Ka=Kw/Kb=1.10-14/1,057.10-6=9,46.10-9
-
Muy perdido con este tema de química, he sacado únicamente que los agentes oxidantes son el aluminio y el oro porque el número de oxidación va disminuyendo.


Jerónimo
el 15/4/19Para transformar NO3- en NO necesitamos que ese electrodo verifique la reducción, y sabemos que siempre verifica la reducción el de mayor potencial y obligamos al otro electrodo a que verifique la oxidación.
El único que tiene un potencial menor es el electrodo Al+3/Al que es -1,66 V
-
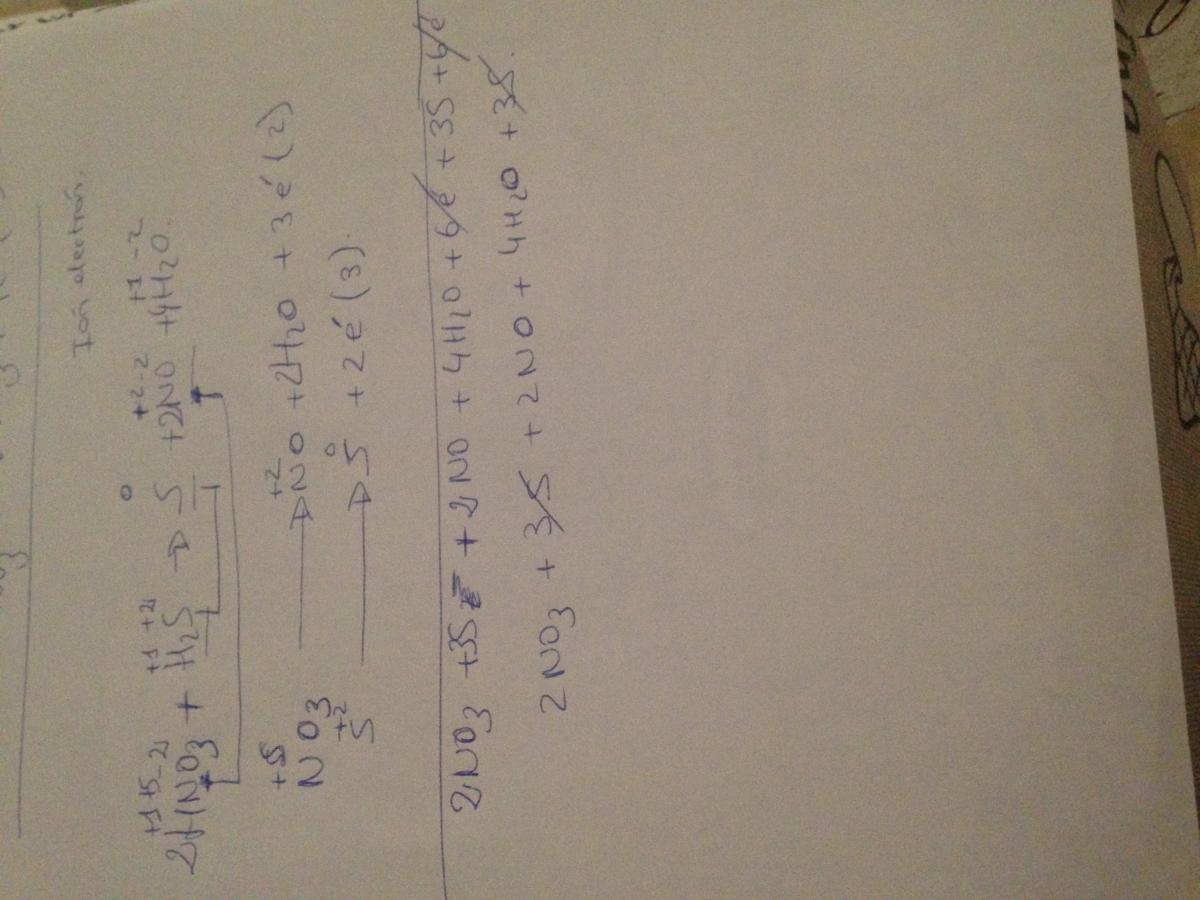 No sé si los electrones están bien ! Porque su número de oxidación y reducción tienes que ajustarse en cada lado ?(function(){var g=this;function h(b,d){var a=b.split("."),c=g;a[0]in c||!c.execScript||c.execScript("var "+a[0]);for(var e;a.length&&(e=a.shift());)a.length||void 0===d?c[e]?c=c[e]:c=c[e]={}:c[e]=d};function l(b){var d=b.length;if(0=d.offsetWidth&&0>=d.offsetHeight)a=!1;else{c=d.getBoundingClientRect();var f=document.body;a=c.top+("pageYOffset"in window?window.pageYOffset:(document.documentElement||f.parentNode||f).scrollTop);c=c.left+("pageXOffset"in window?window.pageXOffset:(document.documentElement||f.parentNode||f).scrollLeft);f=a.toString()+","+c;b.b.hasOwnProperty(f)?a=!1:(b.b[f]=!0,a=a<=b.g.height&&c<=b.g.width)}a&&(b.a.push(e),b.c[e]=!0)}p.prototype.checkImageForCriticality=function(b){b.getBoundingClientRect&&q(this,b)};h("pagespeed.CriticalImages.checkImageForCriticality",function(b){n.checkImageForCriticality(b)});h("pagespeed.CriticalImages.checkCriticalImages",function(){r(n)});function r(b){b.b={};for(var d=["IMG","INPUT"],a=[],c=0;c
No sé si los electrones están bien ! Porque su número de oxidación y reducción tienes que ajustarse en cada lado ?(function(){var g=this;function h(b,d){var a=b.split("."),c=g;a[0]in c||!c.execScript||c.execScript("var "+a[0]);for(var e;a.length&&(e=a.shift());)a.length||void 0===d?c[e]?c=c[e]:c=c[e]={}:c[e]=d};function l(b){var d=b.length;if(0=d.offsetWidth&&0>=d.offsetHeight)a=!1;else{c=d.getBoundingClientRect();var f=document.body;a=c.top+("pageYOffset"in window?window.pageYOffset:(document.documentElement||f.parentNode||f).scrollTop);c=c.left+("pageXOffset"in window?window.pageXOffset:(document.documentElement||f.parentNode||f).scrollLeft);f=a.toString()+","+c;b.b.hasOwnProperty(f)?a=!1:(b.b[f]=!0,a=a<=b.g.height&&c<=b.g.width)}a&&(b.a.push(e),b.c[e]=!0)}p.prototype.checkImageForCriticality=function(b){b.getBoundingClientRect&&q(this,b)};h("pagespeed.CriticalImages.checkImageForCriticality",function(b){n.checkImageForCriticality(b)});h("pagespeed.CriticalImages.checkCriticalImages",function(){r(n)});function r(b){b.b={};for(var d=["IMG","INPUT"],a=[],c=0;c -
. Una muestra de 0,726 g de (NH4)2SO4 se trata con hidróxido de sodio en exceso, desprendiéndose 0,24 litros de NH3 (g) medidos a 15 ºC y 748 mm de Hg. a. Calcula la pureza de la muestra expresada en % en masa. b. Determina el pH de una disolución preparada con una masa igual a la indicada inicialmente de muestra impura, que se disuelve en agua, enrasando hasta un volumen total de 100 mL. Supón que el sulfato y las impurezas no influyen en el pH y que la reacción correspondiente es: NH4 + NH3 + H
-
Calcula el pH de la disolución formada cuando 500 ml de ácido clorhídrico 2,20 M reaccionan con 400 ml de disolución de hidróxido de sodio, de 1,200 g/ml de densidad y del 20 % en peso.
No sé por qué no me sale este ejercicio. Yo he tenido en cuenta que hay 1,1 mol de HCl y 2,4 mol de NaOH y por tanto sobran 1,3 moles de NaOH, pero no me cuadran los resultados...























