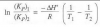-
El NO2, una sustancia de color marrón rojizo, dimeriza para formar N2O4 (un gas incoloro). El equilibrio de dimerización se establece según la ecuación química siguiente:
2NO2⇔N2O4
Se introducen 8,9 g de NO2 en un reactor de 36 litros de capacidad, termostatado a 25 ºC. Una vez alcanzado el equilibrio, la presión total en el interior del recipiente es de 0,1 atm. He calculado el Kc mediante la formula de la presion total que me ha dado 0.1 porque el incremento de N es 0 pero al hacer el aparado A me salen resultados negativos en la ecuaccion de segundo grado con estos datos he hecho el equilibrio: 5.37x10-3 ¿no sera porque la reaccion esta desplazada hacia la izquierda??
a) Determine las presiones parciales (en atm) de NO2 y N2O4 en el equilibrio a 25 ºC.b) Calcule el valor de la Kp a 25 ºC.
c) Indique, razonadamente, hacia donde se desplazará el equilibrio si aumentamos la presión, disminuyendo el volumen del reactor, manteniendo la temperatura constante.
Datos: Masas atómicas relativas: N = 14; O = 16. R = 0,082 atm·L·K-1 ·mol-1 .
-
Buenas unicoos ojalá puedan ayudarme con una duda concreta que tengo sobre el pH. El problema es que en ejercicios de neutralización en los que te dan un pH y tienes que calcular la concentración a partir de H3O cuando H3O no aparece en la concentración. No sé el porque se usa H3O ni nada. Ojalá puedan ayudarme. Igualmente por si no me expliqué bien dejaré un enunciado de un ejercicio. Ojalá me puedan explicar el porque. Muchas gracias de verdad.
Ejercicio : Calcula el volumen 0.5Molar de NaOH que hace falta para neutralizar 250ml de HCl con un pH de 0.44


Breaking Vlad
el 9/3/19Hola Juan Luis,
el pH = -log [H+], o lo que es lo mismo, pH = -log[H3O+], con el valor de 0,44 calcularías el valor de la concentración de H+ (o H3O+) y ese valor es el que luego usarás en la reacción de neutralización.
Es decir, sabes que tienes 250 mL de HCl con una concentración "x"(calculada) de [H+], pues de ahí sacas lo moles, y procedes como con la estequiometría normal.
Espero haberte ayudado,
un saludo,
Breaking Vlad
-


Breaking Vlad
el 9/3/19Hola,
te recomiendo este vídeo:
Equilibrio y temperatura. Ecuación de Van't Hoff
Una vez lo hayas intentado por tu cuenta siéntete libre de preguntar las dudas concretas que te hayan salido por el camino
Un saludo,
Breaking Vlad
-
) Determine la entalpía de formación del peróxido de hidrógeno a partir de los siguientes datos:
2H2(g) + O2(g) → 2H2O(l) ∆H = -571 kJ
H2O2(l) → H2O(l) + 1/2O2(g) ∆H = -98 kJ aqui he llegado a la conclusión de que si para el peroxido a sus reactivos es necesario -98kj entonces la entalpia de formacion seria lo contrario 98kj.


Breaking Vlad
el 8/3/19Hola Mohamed,
has de utilizar la ley de Hess. Las entalpías de formación consisten en coger los ATOMOS(elementos) que forman una sustancia y juntarlos todos por separado.
es decir, para el H2O2 sería:
O2(g) + H2(g) -> H2O2(l)
Por lo que has de intentar combinarlas de modo que sumadas, den esa reaccion, prueba a darle la vuelta a alguna.
Échale un ojo a este vídeo y nos cuentas:
Ley de Hess | TermodinámicaUn saludo,
Breaking Vlad
-
Buenas tardes me puede explicar alguien como funcionan las reacciones químicas
Algo asi como CH~4 +O2::::> H2O ES un ejemplo se que esta mal


Jerónimo
el 7/3/19Una reacción química se produce cuando las sustancias participantes en ella se transforman en otras distintas.
A las primeras se les llama reactivos y a las segundas productos. La masa de las sustancias participantes es la misma antes y después de la reacción, es decir, se conserva. Esto sucede porque sólo se lleva a cabo un reordenamiento entre los átomos de los reactivos, que se rompen y forman nuevos enlace
-
No se si he echo bien los problemas. ¿Están bien? Soy estudiante del grado superior de salud ambiental. Son problemas de disoluciones




Breaking Vlad
el 6/3/19Hola Talia,
en el ejercicio 4 lo tienes mucho más fácil. Te están hablando de peso, no necesitas para nada los moles de nada.
12% = psoluto/pdn; pdn= psoluto/0,12
con la densidad pasas el peso de la disolución a mL y listo! te debe dar un volumen notablemente mayor que 1L.
en el ejercicio 1 no te están pidiendo gramos de nada. te piden como prepararías esa disolución partiendo de otra disolución. Así que el resultado final no debe ser "un número" sino una explicación del procedimiento.
De todos modos, veo una serie de fallos en el enunciado. 1. te han de dar el volumen que has de preparar de disolución. 2. ¿la densidad de qué es? ¿del 10%(v/v), del 5N? por otro lado, si te piden 10%(v/v) quiere decir que hay 10mL de HCl puro(volumen) por cada 100mL de disolución. Teniendo en cuenta que el HCl puro es un gas... es un tanto extraño que te lo formulen así. Este enunciado requiere más aclaraciones.
Un saludo,
Breaking Vlad
-
alguien me podri ayudar a resolver este problema ¿Qué volumen de sulfuro de hidrógeno (SH2) medido a 27 ºC y 900 mm de presión pueden obtenerse con un exceso de ácido sulfúrico (H2SO4) y 500 gramos de sulfuro ferroso (SFe) del 85 % de riqueza?.