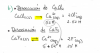-


Breaking Vlad
el 9/12/19Una flecha es cuando la reacción es irreversible. Es decir, cuando NO es un equilibrio.
La de arriba es una disociacion completa de una sal (cloruro de calcio) y la de abajo es un equilibrio de solubilidades del fluoruro de calcio.
Por lo general, cuando sea necesario te lo especificarán de alguna manera en el enunciado.
Un saludo,
Vlad
-

Martin
el 9/12/19Este video te ayudara para el reactivo limitante: https://www.youtube.com/watch?v=if3MnLph0Vs

Rafamad435
el 8/4/24Muy buen video, te agradezco por haberlo compartido.
--------------------------------------
Trabajo en https://copisa.com.mx
-


Breaking Vlad
el 9/12/19Cuando añades HCl a la disolución de Ca(OH)2
estás disociando los dos compuestos: H+ Cl- y el equilibrio de disociacion del hidróxido de calcio.
entonces, en disolución: H+ + OH- reaccionan para dar H2O. Eso hace que se gasten los OH-, y según el principio de Le Châtelier, el equilibrio de disocación del hidróxido de calcio se desplazará hacia la derecha, aumentando la solubilidad.
Un saludo,
Vlad