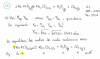-
Hola! Alguien me puede explicar donde está mi error? Por que me sale negativo y no positivo? Es el ejercicio 16
-
me pide que ponga la estructura de lewis del BeI2 (Yodo 2) y que justifique el octeto incompleto que surge. Gracias


Breaking Vlad
el 14/11/19Se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis siempre también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro.
-
Hola! Necesito ayuda con el siguiente problema:
En quemar una muestra de un hidrocarburo, se forman 7.92g de CO2 y 1.62g de vapor de agua. La densidad del hidrocarburo gaseoso es de 0.82g/dm3 a 85 grados C y 700mmHg.
Determinar la fórmula molecular.
Primero he determinado la empírica, que me ha salido CH. Ahora, para saber la molecular debería de saber n, que es igual a Mm de fórmula molecular/Mm fórmula empírica. La Mm de la empírica la se, pero y la Mm de a fórmula molecular? Debería de sacarlo con la densidad, temperatura, presión. He utilizado la ley de los gases ideales, pasando la densidad a cm3, temperatura a K y presión a atm, pero n me sale que es 2·10^-3. No veo el error.
Espero que alguien me pueda ayudar. Gracias
-
Hola! Alguien me puede ayudar con el siguiente problema?
Un compuesto orgánico está formado únicamente con C, H y S. Determina la fórmula empírica si cuando se queman 3g de sobtiene 6g de CO2 y 2g de agua.
Se como se calcula la fórmula empírica, pero para ello necesito saber moles de C, H y S. C y H se calcularlo, mi problema es, y el S?
Espero vuestra respuesta. Muchas gracias y un saludo!
-
Hola, alguien sabe hacer los hidrocarburos aromáticos? alguien me lo explica?. Gracias


Breaking Vlad
el 14/11/19Hola Anastasia,
¿A qué te refieres con "saber hacer"?
Formulación? Síntesis?,...
Si es lo primero, puedes encontrar información en Química Orgánica
Un saludo,
Vlad
-