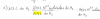-

lucia1902
el 4/10/19Buenas, creo que es porque se está usando el factor unitario, que se usa como alternativa (creo que es la más recomendada) a la regla de tres.
Si resuelves el ejercicio por regla de tres te da lo mismo.
22,4 l ____ 6,022*1023 moléculas
11,2 l____ x=3,012*1023 moléculas
Te recomiendo que busques videos sobre el factor unitario si quieres entender el procedimiento, pero usando regla de tres te da el mismo resultado
-
Hola! Me podríais ayudar con el siguiente problema?
El amoniaco reacciona con el oxígeno de acuerdo con la ecuación química: 4NH3(g) + 5O2(g) --> 4NO(g) + 6H2O(g)
Partimos de una mezcla gaseosa formada por 5 litros de amoniaco y 20 litros de oxígeno, medidos en las mismas condiciones de presión y temperatura. Si sabemos que se mantienen las condiciones de presión y temperatura, calcula cuál será la composición volumétrica de la mezcla gaseosa después de la reacción.
Se que trata de los gases ideales. Si yo aplico la ecuación: p·V=nRT, si las presiones y temperaturas no cambian, el volumen tampoco, no? Pero claro, me pide la composición volumétrica, eso me lía.
Espero que alguien me pueda ayudar.
Espero vuestra respuesta, muchas gracias de antemano!
-
Hola, según la IUPAC 2005 son hidruros las combinaciones del hidrógeno con elementos hasta del grupo 15, y por tanto según esto, en el amoniaco el N tendría EO +3 , sin embargo en el amoniaco siempre se consideraba EO -3 del N... ¿cómo se explica esto?


David Moldes
el 3/10/19Se debe a la electronegatividad (propiedad que nos dice qué átomo tiene más tendencia a atraer los electrones). En el grupo 15, el N tiene mayor electronegatividad que el hidrógeno, por tanto los electrones de enlace le "pertenecerán" más a él, y por eso se dice que tiene estado de oxidación -3 (mientras que como cada H tiene los electrones más alejados, por eso tiene estado de oxidación +1).
Sin embargo, al bajar en el grupo, la electronegatividad decrede, y ya el Al es un elemento menos electronegativo que el H, y por tanto será el H el que atraiga los electrones, quedándose con estado de oxidación -1, que es a lo que llamamos hidruro.
-
Hola, ¿por qué es mayor el punto de fusión del Mg que el del Na? en general ¿cómo varia el punto de fusión en los metales?


Jerónimo
el 3/10/19Los alcalinoterreos son más duros, densos y resistentes a las temperaturas que los metales alcalinos. Esta diferencia reside en sus átomos, o lo que es igual, en sus estructuras electrónicas, como sabes, los alcalinos tienen un electrón en su última capa y los alcalinoterreos 2 e-.
Otra cosa por la que no se puede hablar de homogeneidad en sus T de fusión es por las diferentes estructuras cristalinas cristalinas
-
Reducción: Ag+(ac) + e- --> Ag(s) E°Ag+/Ag= 0.80 V
Oxidación: Ag(s) + Br-(ac) --> AgBr(s) + e- E°Ag/AgBr = 0.07 V
------------------------------------------------------------------------
Ag+(ac) + Br-(ac) --> AgBr(s)
E° = 0.80 V - 0.07 V = 0.73 V
E°= (RT/nF)*lnK
A 25 °C
E° = (0.0592/n)*logK
n = 1
K= 1/((Ag+)*(Br-))
K = 10^((E°*n)/0.0592) = 10^((0.73V)*1/0.0592)) = 2.14x10+12
AgBr(s) <====> Ag+(ac) + Br-(ac)
Kps = (Ag+)*(Br-) =1/K = (1/2.14x10+12) = 4.67x10-13
En el guía da 5x10-3 y a mi me da 4.67x10-13 ¿Tengo algún problema en mi procedimiento?