-
Lo que hice es hallar la concentraciones molares de los reactivos y el producto, dividiendo la cantidad de moles que dice la letra entre 0,50L
Así que la concentración de I es de 1M, la de H es de 0,4M y la de HI es de 2M.
Con esas concentraciones plantee el cociente de reacción
Qc=2/(1*0,4)=5
Y como me dio 5, distinto a la constante de equilibrio, significa que no hay un equilibrio en esa situación. ¿Es correcto?
-
Buenos días, por favor, necesito que alguien me ayude con éstos 3 ejercicios, es para explicárselos a mi hijo, un millón de gracias.
5. 1. El siguiente cuadro representa las temperaturas de fusión y ebullición del agua y del mercurio a 1 atm de presión.
Sustancia T. de Fusión T. de Ebullición
Mercurio -39ºC 357ºC
Agua 0ºC 100ºC
¿En qué estado se encontrarán si la temperatura es de -25 °C, 50 °C o 360 °C?
6. Dados los datos de cómo varían la presión y el volumen de un gas (Tª constante)
Presión (mm de Hg) Volumen (litros) P.V
300 20 6000
400 15 6000500 12 6000
600 10 6000
Representa la presión frente al volumen y escribe cómo se llama la ley que relaciona las dos magnitudes. ¿Qué volumen ocupará dicho gas a una presión de 1000 mm de Hg?
8. Una jeringa contiene cierta cantidad de aire en su interior. A continuación hacemos que el émbolo descienda. De las variables siguientes, justifica cuáles crees que se han visto modificadas y cuáles no.
a) Masa
b) Volumen
c) Densidad
d) Presión
-
Hola! Necesito ayuda con esté ejercicio porfi:
Se prepara na disolución concentrada de ácido nítrico. De dicha disolución se toman 100cc y se diluyen en agua hasta preparar un litro de otra disolución diluida del mismo ácido. Se hacen reaccionar ahora 250 cc de está disolución con cinc, y se consumen en el proceso 2,54 g de éste.
a)Calcular la molaridad de la disolución concentrada de ácido nítrico.
b)La cantidad de cinc que reaccionaría con 2500 cc de la disolución concentrada.
Mil gracias!!!
-
Hola, respecto a la ley de proporciones reciprocas: por ejemplo el carbono forma CO2 y CH4, las relación de las masas de O e H que se unen a 12 g de C es 32:4 y existe un compuesto el H2O, que cumple esa relación.
Pero por ejemplo en el NH3 y el NO, no se cumple esta ley no??
-
Hola, tengo algún problema con el uso del grado de disociación en reacciones con coeficientes estequiométricos distintos de uno, os adjunto un problema, que plantean la disociación de una forma que yo no entiendo y las formas en que yo lo haría, a ver si me podéis decir donde cometo el error. Gracias
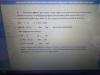


Breaking Vlad
el 15/10/19Hola Teresa
efectivamente es como dice la resolución. Has de considerar que lo que se ha consumido es el 83% (α=0.83) de modo que lo que te sobraría sería la concentración inicial x(1-α).
Si multiplicas α*4 podrás ver que te da 3.32 (332%), y no tiene sentido que se consuma más del 100%.

Teresa
el 15/10/19Siii eso lo veo... yo en el caso que planteo efectivamente estoy considerando que 4alfa=0,83.... o alfa=0,83 en el segundo planteamiento que hago--- lo que no entiendo de la resolución es por qué pone una concentración común a ambos reactivos c y luego la delHCl la multiplica por 4... porque puede que haya más cantidad de oxigeno que de cloruro no??
-

Teresa
el 10/10/19En la reacción hierro mas ácido sulfúrico dando hidrógeno y sulfato de hierro(II), todos los compuestos tienen coeficiente estequiometrico 1, lo cual indica que el hierro y el ácido reaccionan mol a mol.
Tienes 2,3 gramos de hierro, lo cual supone, si lo dividimos por la masa atómica, que son 0,041 moles de hierro
Tienes 0,2 l de disolución en la que hay 0,5 moles/litro, lo que significa que tienes 0,1 moles de ácido.
Como la estequiometria es 1:1 el primero que se gasta es el hierro, es por ello el reactivo limitante.
b. sabemos entonces que habrán reaccionado los 0,041 moles de hierro con los mismos de ácido y como la relación entre el hierro y el hidrógeno es 1:1 (porque todos los coeficientes estequiométricos son 1), pues se formarán también 0,041 moles de hidrógeno, que considerándolo ideal y aplicando pV=nRT , donde n es el numero de moles=0,41 y las condiciones normales son P=1atm T=273K despejas el volumen y da 0,9 l
-
Hola! ¿Alguien me puede ayudar con el clorotrioxosulfato(VI) de hidrógeno?


David
el 14/10/19(H2SO3) Es triosulfato(VI) de hidrogeno...
HSO3 Cl es clorotrioxosulfato(VI) de hidrógeno
Por si te ayuda... https://www.docsity.com/es/formulacion-inorganica-ejemplos/3085908/



















