-
Hola, cuando en los libros viene explicado el criterio de espontaneidad de las reacciones químicas, indica que bajo ciertas condiciones que son:
-P constante
-T constante
-No existencia de trabajo distinto al de expansión
bajo esas condiciones se dice que si dG=0 equilibrio, dG>0 no espontánea y dG<0 espontánea
Mi pregunta es, en una reacción redox, existe un trabajo eléctrico, es decir diferente al de expansión, y sin embargo se emplea el mismo criterio de espontaneidad no?? Si es así, por qué en los libros detallan esa condición al definir el criterio?

Teresa
el 26/8/19https://books.google.es/books?id=3DuAzzYUpbYC&pg=PA106&lpg=PA106&dq=trabajo+util++y+su+relacion+con+helmholtz&source=bl&ots=cfBY4e2Udf&sig=ACfU3U31EM-CiA7QgyUWfayrLjrpAd06CQ&hl=es&sa=X&ved=2ahUKEwi8r6DriqDkAhW4TxUIHeZmCroQ6AEwBXoECAkQAQ#v=onepage&q=trabajo%20util%20%20y%20su%20relacion%20con%20helmholtz&f=false
En la pagina 107 al final vienen las 3 condiciones para aplicar la variación de Gibbs como criterio de espontaneidad, parece lógico, pues solo con trabajo de expansión ΔGreac=-TΔSUniv y asi podemos vincular los signos de la entropía del universo que es el criterio de espontaneidad real, con los signos de la energía libre.
Ahora bien si existe trabajo útil, después de los correspondientes termodinámicos, llegamos a ΔGreac=-TΔSUniv + WÚtil y por tanto aquí la vinculación de los signos de la propiamente del universo con Gibss no es tan clara, por que afecta el termino de trabajo útil..
El problema que tengo es que luego llega la practica y por ejemplo en reacciones redox que si existe trabajo útil, se usa el criterio como si no existiese.
-
Hola!! relación entre Qp y Qv : QP= Qv+ PΔV y sabiendo que PΔV =ΔnRT queda QP= Qv+ ΔnRT , ahora bien no puedo suponer que la variación de volumen es debida una variación de temperatura y entonces QP= Qv+nRΔT ???


Breaking Vlad
el 26/8/19Hola Teresa,
sí sería posible, sin embargo, eso implicaría que el número de moles es constante, lo cual no es frecuente en el ámbito de la química.
Generalmente, para facilitar el estudio de las reacciones termodinámicas, se trabaja en sistemas isotermos, de modo que la variación en presión se debe a la formación, o desaparición de moles de gas.
Un saludo,
Vlad
-
Hola me gustaría la obtener la explicación de la solución de uno de los ejercicios de mi libro de química de 2º de Bachiller, recalco que tengo la respuesta pero no entiendo la explicación de esta, el enunciado dice lo siguiente:
Una muestra de H2S contiene 14,112 g de azufre y 0,888 g de hidrógeno. Otra muestra de sulfuro de calcio contiene 2,053 g de azufre y 2,497 g de calcio. Halla el peso de combinación del calcio.
Y la solución dice lo siguiente:
Hay que obtener para comparar las Mat del S: 32,06; Ca: 40,08. El peso de combinación es el peso con el que se combina un elemento con el hidrógeno. La ley de Richter indica que los pesos de elementos diferentes que se combinan con un mismo peso de un elemento dado son los pesos relativos de aquellos elementos cuando se combinan entre sí o un múltiplo o un submúltiplo. Para hallar el peso de combinación del calcio tendremos que saber su combinación con el hidrógeno. 14,112 g S/0,888 g H = 2,053 g S/x g H obteniéndose 0,129 g H. Por otro lado la relación de azufre en el sulfuro con el calcio es 2,497 g Ca, luego 2,497 g Ca/0,129 g H = x/1,0 g H obteniéndose 19,36 g que corresponde a la mitad aproximadamente de la masa atómica del calcio (38,72). La combinación del azufre con el hidrógeno y con el calcio es la mitad en masa.
Me sería de gran ayuda si alguien pudiera explicármela, muchas gracias.
-
¿Que medio (acido o basico) producirian las siguientes especies en disolucion con agua?
-Hidroxido de calcio
-Sulfuro de sodio
Si el sulfuro de sodio en disolucion con agua resulta en un acido y una base entonces tengo que determinar cual es constante es mas alta de esas dos?
Y respecto al hidróxido, me perdí un poco.


Jerónimo
el 24/8/19Hidrólisis - Valoración ácido debil base fuerte
El hidróxido de calcio es una base fuerte , en disolución acuosa produce medio básico.
El sulfuro de sodio es una sal soluble, disociandose en el anión S-2 y el catión Na+.
Na+ no sufre hidrólisis (repásate la teoría) y el S-2 acepta protones dejando la disolución básica
-
Buenas tardes, necesito ayuda con el siguiente problema:
A una disolución acuosa que contiene iones Ca2+ en concentración 0.0075M se le añade NaF (s) apareciendo un precipitado de CaF2 .
Cacule la concentración de F- que hay que alcanzar para que precipite el 99.5% del Ca 2+ de la disolución.
Kps (CaF2)= 3.2*10^-11
-
Hola, tengo dudas con el siguiente ejercicio, estoy confundida a como llegar al resultado
La materia orgánica de una muestra de 1.2052 g de un preparado para quemaduras fue eliminada reduciéndola a cenizas, y posteriormente el residuo solido de ZnO se disolvió en ácido. El tratamiento con (NH4)2C2O5 dio por resultado la formación de ZnC2O5( muy poco soluble). El solido se filtro, lavo y después se redisolvio en ácido diluido y se llevo a un volumen de 250.0 mL. De este se tomo una alícuota de 10.00 mL y llevo a un volumen de 100.0 mL. Finalmente de este ultimo volumen se tomaron alícuotas de 10,00 mL en donde el H2C2O4 liberado necesito en promedio 17.81 mL de KMnO4 0.01508 M
a) Calcule el % de ZnO en el preparado
se que el resultado es 11,33% , pero llego a algo totalmente distinto :c
-
¿El pH de una valoración ácido-base en el punto de equivalencia, coincide con el pH de la sal que forman estos dos?
-
Necesito ayuda con el siguiente problema:
El cloro gaseoso (Cl2) puede obtenerse en el laboratorio, en pequeñas cantidades haciendo reaccionar el dióxido de manganeso con acido clorhídrico concentrado, según: MnO2 (s) + 4HCl (aq) -> MnCl2 (aq) + Cl2 (g) + 2H2O (l) S
Se hace reaccionar 100g de MnO2 con 0,8 L de disolución de HCl del 35,2% en masa y densidad 1,175gcm3.
Calcule la molaridad del acido empleado.
Datos: Mat: H: 1 u.m.a., Cl: 35,45 u.m.a
-
Buenas tardes, ¿cómo puedo pasar de kj a kj/mol?

Sara
el 13/8/19La reacción de formación del matanol es:
C (s) + 2H2 (g) + ½ O2 (g) -> CH3OH(l)
A partir de las ecuaciones químicas siguientes:
CH3OH (l) + 3/2 O2 (g) -> CO2 (g) + 2H2O (l) ΔH˚= - 725 kJ
C (s) + O2 (g) -> CO2 (g) ΔH˚= - 393 kJ
H2 (g) + ½ O2 (g) -> H2O (l) ΔH˚= -286 Kj
Calcula la entalpía molar de formación de metanol


Jerónimo
el 14/8/19CO2 (g) + 2H2O (l) ->CH3OH (l) + 3/2 O2 (g) ΔH˚= 725 kJ
C (s) + O2 (g) -> CO2 (g) ΔH˚= - 393 kJ
2H2 (g) + O2 (g) -> 2 H2O (l) ΔH˚= 2 x (-286) Kj
......................................................................................................................
C (s) + 2H2 (g) + ½ O2 (g) -> CH3OH(l) ΔH˚= -240 Kj/mol
-
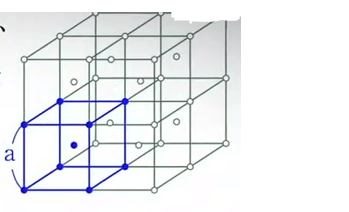
No pedí que me resolvieran el ejercicio, pero necesito una pauta o pie para comenzar, algún método por el cual abarcar el problema. Entiendo lo que pide pero no sé la manera de hacerlo.
Como se muestra en el diagrama, la red cristalina con centro interno consiste en múltiples cubos de lado “a”, que tienen átomos de Na, K, o algún metal alcalino en cada vértice y en el centro. Ubíquese en un átomo A en el centro de cualquier cubo. De todos los puntos en ese espacio, el dominio D es el conjunto de puntos que están más cerca de A que de cualquier otro átomo. Calcular el volumen de D.