-
Buenas, tengo una pregunta, a ver si alguien me puede ayudar. Un átomo de hidrógeno tiene un único electrón. ¿Podría sucedes que su configuración electrónica fuese 2s1 en vez de 1s1? ¿En qué caso?
Muchas gracias.
-
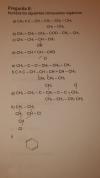 Buenos días, he estado revisando los videos para resolver formulas de compuestos organicos y no me queda muy claro como hacerlo
Buenos días, he estado revisando los videos para resolver formulas de compuestos organicos y no me queda muy claro como hacerlo
Martin
el 12/8/19Te voy ayudar con algunos, porque por ejemplo el ejercicio a) falta una enlace para unir el CH2-CH3 que aparece abajo del ejercicio.
b) butanoato de etilo.
c) 2-butanol
d) El enlace sale corrido, no se sabe a donde esta unido
e) etil propil eter
f) Tambien aparecen movidos los enlaces pero deduzco q deberia ser: 4-etil-3-metil-hex-1-ino-5-eno
g) Los enlaces aparecen movidos.
h) 1,2-diclorociclopentano
i) 1,4-hexadieno
El canal de Breaking Vlad explica muy bien la nomenclatura de todos los grupos funcionales.
Siempre fijate donde se encuentra el grupo funcional mas importante y cual es la cadena mas larga de carbonos
-
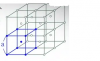
Como se muestra en el diagrama, la red cristalina con centro interno consiste en múltiples cubos de lado “a”, que tienen átomos de Na, K, o algún metal alcalino en cada vértice y en el centro. Ubíquese en un átomo A en el centro de cualquier cubo. De todos los puntos en ese espacio, el dominio D es el conjunto de puntos que están más cerca de A que de cualquier otro átomo. Calcular el volumen de D.
-
En la fase gaseosa el dióxido de nitrógeno es en realidad una mezcla de dióxido de nitrógeno y tetraocido de dinitrogeno. Si la densidad de dicha mezcla es de 2,3g/L a 74°C y 1,3 atm ¿Cuáles son las presiones parciales de los gases y la Kp de la disociación del N2O4?
-
-
Formula condesada
5-isopropil-3,3,4-trimetiloctanoYo puse esto pero no estoy seguro para nada, me confundi en como anotar la parte del isopropil:
CH3CH2C(CH3)2CH(CH3)CH((CH)(CH3)2)CH2CH2CH3
Eso en negrita siria la parte del isopropil pero creo que no esta bien me podrian ayudar plz
-
Hola!
Encuentro en varios sitios los siguientes ácidos de silicio nombrados de la siguiente manera:
H6Si2O7 ácido pirosilico
H2Si2O5 ácido disilicico
Esto me confunde, pues hasta donde yo creía saber el prefijo piro y di son lo mismo, vamos que se ha sustituido piro por di... entonces no entiendo la diferencia en la formula, según yo creo si las formas piro/di se hace por condensación de dos molecular de ácido y una perdida de agua partiendo del ácido silicio, H4SiO4, tendríamos H8Si2O8 - H2O= H6Si2O7, y este seria antiguamente el ácido pirosilicico y ahora el ácido disilicico. Me pueden ayudar, gracias
-
Hola, cuál seria la nomenclatura de adición del ácido disulfúrico (antes ácido pirosulfúrico)?? Que dice el libro rojo de la IUPAC 2005 respecto estos oxoácidos, que antes se distinguían como orto, piro, meta, según el numero de moléculas de agua??