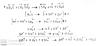-
Hola, pude resolver el ejercicio anterior que puse. Gracias.
Ahora me piden balancear esta ecuación por medio ácido:
H2S + H2SO4 = SO2 + S + H2O
Vi el vídeo de unicoos y lo resolví por mi cuenta. Esto fue lo que obtuve:
Creo que esta mal porque los hidrógenos no me quedaron balanceados.
Alguien me puede decir si hay algún error?
Otra cosa que no comprendo es si es posible que en una reacción un elemento sea el que se reduce y se oxide (en diferentes compuestos). Lo digo porque aquí el único que cambia su estado de oxidación es el azufre, y no se si pueda hacer lo que hice, de involucrar al azufre en las semi-reacciones tanto de reducción y oxidación.
Gracias de antemano!!
-
Muy buenas Unicoos, necesito ayuda con este problema. Se que lo mejor seria mostrar mi progreso y que la ayuda partiera de ahí pero, sinceramente, no sabría ni por donde empezar. Agradecería si alguien me pudiera hacer una explicación aunque fuese breve para poder entenderlo y aprender a resolver problemas de este tipo.
Muchísimas gracias de antemano. Un saludo!
PD.: ¿Hay algún vídeo que explique este tipo de problemas? Así también podré ahorrarme futuras dudas de este estilo.
Muchas gracias de nuevo!!
-
Hola me pueden ayudar en balancear esta ecuación redox por medio basico:
NH3 + O2 → NO + H2O
Gracias de antemano!!


Breaking Vlad
el 27/5/19Hola Leon,
prueba viendo este vídeo:
Ajustar reacciones mediante el método redox en medio básico
si te siguen quedando dudas después, vuelve a preguntarnos las dudas concretas.
-
por que el BeF2 es un enlace covAlente molecular y no es un enlace ionico si es un metal(be) con un no metal (F)
-
Para que un glucido tenga carácter reductor, en necesario que se trate de un disacárido o también lo pueden ser los monosacáridos?
-
Holaa buenas ¿alguien podría resolverme este ejercicio?:
Sobre un catalizador de platino, el monóxido de carbono reacciona fácilmente con el oxígeno para transformarse en dióxido de carbono. ¿Qué volumen de dióxido de carbono será si reacciona completamente 12 litros de monóxido de carbono en condiciones normales? ¿Qué volumen de oxígeno se ha consumido?
Por estequimoetría y por la fórmula PV=nRT, ya que no entiendo porqué dicen que 1 mol son 22,4 litros y por ambas lo utiliza y de ninguna de las formas me da la solución
Gracias!!


Jerónimo
el 26/5/19Ley de Gay-Lussac o de los volúmenes de combinación
CO + 1/2 O2-----------→CO2
12 litros 6litros 12 litros