-
Buenas!
En compuestos como FeN o CoS
En la resolución de selectividad los nonbra como
-nitruro de hierro (III)
-sulfuro de cobalto (II)
Sería correcto nombrarlos tamb como:
-(mono) sulfuro de cobalto?
-(mono)nitruro de hierro?
Según mi profesor ambas deberían ser correctas pero me da miedo.
Gracias
-
83) tengo la impresión de que la expresión de kp de este ejercicio esta errada:
Pnh3 = xnh3*Pt Ph2 = xh2*Pt Pn2 = xn2*Pt
Kp= Pnh3^2/Pn2*(Ph2)^3= (xnh3)^2*Pt^2/(xh2)^3*Pt^3*(xn2)*Pt = ((xnh3)^2/(xh2)^3*(xn2))*1/Pt^2
Como ve el Xh2 queda elevada a la 3 no a la 2 como en la expresión que me piden demostrar, me gustaría verifica si mi razonamiento es correcto.
84) despejando la ecuación del ejercicio 83 me queda:
xnh3^2 = 0.0906*Pt^2*xn2*(xh2)^3
Si bien Pt = 1 atm como no tengo las fracciones molares de xn2 y xh2 demas de no tener los moles de cada uno, no puedo proceder a sacar el porcentaje de moles NH3 ( y no se con respecto a que hallar el porcentaje)
-
2H2(g) + CH4 (g) <==========> CS2 (g) + 4H2 (g)
Eq(mol) 0.00954 nch4 ncs2 nh2
Pt(eq) = 1 atm
0.00142 mol BaSO4 (Originalmente del CS2)
Pt(eq) = Ph2s +Pch4 + Pcs2 + Ph2 = 1 atm
nt = nh2s + nch4 + ncs2 + nh2
Kp = (Pcs2*((ph2)^4))/(((Ph2s)^2)*Pch4))
Mi problema es que no se que hacer con los moles de BSO4 ya que no tengo la reaccion de como el H2SO4 se convierte en en BaSO4 y lo mismo aplica con el CS2 ya que tampoco se la reaccion de como pasa a H2SO4 , me gustaria que me den una mano.


Breaking Vlad
el 23/5/19Hola Daniel,
el BaSO4 se utiliza para saber los moles que tienes de CS2 y así saber los moles finales en equilibrio y terminar de completar la tabla.
del BaSO4 puedes calcular los moles de H2SO4. y sabiendo que cada sulfúrico tiene 1 átomo de azufre, y estos salen del CS2, sabes que por cada una de CS2 se obtendrán 2 de H2SO4. De modo que puedes calcular también el CS2. Y a partir de ahí ya es lo de siempre. Moles totales, presion total, Kp,...
Un saludo,
Breaking Vlad
-
Buenas tardes, necesito ayuda con el siguiente problema:
Cuando se mezclan 10 mL de una disolución de KI 0.1M con 80 mL de una disolución de Pb(NO3)2 0.01M se forma un precipitado amarillo de PbI2. Calcule Qps y justifique la formación del precipitado.
-
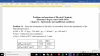
Hola Unicoos, soy estudiante de enfermeria y esta ultima semana tuve problemillas con unos problemas que recuerdo haber estudiado hace un par de años gracias a videos de unicoos. Como vereis, en la imagen adjunta esta todo lo que consegui copiar en clase, tanto enunciado como solucion. El problema es que por mas que lo intento no consigo entenderlo. Agradeceria si alguien pudiera hacerme una explicacion o pasarme el link de algun video de David que lo explique (ya que he buscado pero no he encontrado lo que buscaba).
PD.: Por si no se entendiera el enunciado del problema en la foto, es este: Indique los volumenes necesarios de adrenalina y suero salino para preparar 150 mL de una solucion que contenga 1200 microgramos de adrenalina en suero salino. El volumen de una ampolla de adrenalina es 0,1% de 1mL. Si de la solucion preparada extraemos 20mL y se los añadimos a 100mL de suero salino, ¿qué concentración en porcentaje de adrenalina tendra la nueva disolución?
Muchisimas gracias de antemano. Un saludo!!


Breaking Vlad
el 23/5/19Hola Ivan,
Creo que hay una errata en el enunciado. en 1 mL de disolucion 0,1% (imagino 0,1g por cada 100 mL) en ese mililitro debe haber 1 mg de adrenalina.
Puesto que necesitos 1200 microgramos, que es 1,2mg, no tienes suficiente en todo el vial.
Si los datos son todos correctos, me temo que este ejercicio está mal planteado.
Un saludo,
Breaking Vlad
-
T=1024°C = 1297°K
4CuO(s) <=======> 2Cu2O(s) + O2 (g)
Ini (mol) : y 0 0
Reacción: -4x +2x +x
Eq(mol): y - 4x 2x x
Eq(atm) ------------ ------------- 0.49
a) Kp =Po2 = 0.49
Mi duda viene en la b, c y d
b) 4CuO(s) <=======> 2Cu2O(s) + O2 (g)
Ini (mol) : 0.16 0 0
Reacción: -4x +2x +x
Eq(mol): 0.16 - 4x 2x x
Eq(atm) ------------ ------------- 0.49
Po2 =no2*R*T/V no2= Po2*v/R*T = (0.49*2)/(0.0821*1297) = 0.0092 mol
no2 = x => 4x = 4*0.0092 mol = 0.037 mol
c) 4CuO(s) <=======> 2Cu2O(s) + O2 (g)
Ini (mol) : 1 0 0
Reacción: -4x +2x +x
Eq(mol): 1 - 4x 2x x
Eq(atm) ------------ ------------- 0.49
Po2 =no2*R*T/V no2= Po2*v/R*T = (0.49*2)/(0.0821*1297) = 0.0092 mol
no2 = x => 4x = 4*0.0092 mol = 0.037 mol
Como pude ver indistintamente de la cantidad de CuO que tenga inicialmente el resultado es invariante pero la respuesta b del libro es 0.23 y a mi en ambos casos me da 0.037 esa es mi duda que estoy haciendo mal en este ejercicio.
d) Si tomo que lo que se descompone de CuO es 0.037 por lo que este seria mi valor mínimo (para ser mas preciso un poco mas de este para estar en equilibrio químico)
reply

Breaking Vlad
el 22/5/19Hola Daniel,
lo del apartado b) es muy simple. Lo has hecho correcto todo, PERO lo que te piden es la FRACCION de CuO que descompone.
Sabes que lo que descompone es 4x: 0,037 mol. Pero la fracción es lo que se ha descompuesto entre lo que había inicialmente: 0,037/0,16 = 0,23
Todo lo demás lo tienes bien, sigue así!
Un saludo,
Breaking Vlad
-
0.150thor*1/760 = 0.197 atm =>Pco =nco*R*T/v
Concentración de CO= nco/V= Pco/R*T = 0.197/(0.0821*1600) = 0.0015 mol/l = 0.00149 M
NiO(s) + CO(g) <=============> Ni(s) + CO2 (g)
Inicial(thor) --------- 150 ------ 0
Inicial(atm) --------- 0.197 ------ 0
Inicial (M) --------- 0.00149 ------ 0
Reacción (atm) ---------- -x ------ +x
Reacción (M) --------- -y ------ +y
Eq(atm) ---------- 0.197 - x ------ +x
Eq(M) ---------- 0.00149 - y ------ +y
Pt en equilibrio (Pt(eq)) < 760 thor = 1atm
Kc = (CO2)/(CO) => 602 = y/(0.00149-y) => 0.897 - 602y = y => 0.897 = 603y => y =0.0014875 M esto se asemeja a 0.00149 M
Entonces se consume prácticamente el CO y si ocurre la reducción PERO mi duda es que la respuesta es distinta a la que aparece en el libro y no se si mi razonamiento es correcto, ademas no termino de entender de que me sirve Q ya que cuando digo Qc = (CO2inicial)/(COinicial) = 0/0.00149 = 0 y como Qc<Kc entonces la reacción tal como deduje se desplaza hacia la derecha, aun asi el libro saca la Q maxima (y no se como llego a ese valor).


Breaking Vlad
el 22/5/19Hola Daniel,
este ejercicio es más simple de lo que parece.
Has de plantear Q, y compararlo con K.
sabemos que si Q<K, la reacción se desplaza hacia la derecha, es decir, sucede en la dirección del CO2.
Nos dicen que introducimos 150 Torr (que aunque Thor mole un montón, se dice Torr ;) ) de CO y que la presión total nunca excede los 760 Torr
esto quiere decir que en el peor de los casos, si el resto fuera CO2 (610 Torr), Q=PCO2/PCO=610/150 =4.1
como Q<K, la reacción se desplaza a la derecha, produciendo la reacción
Un saludo,
Breaking Vlad
-