-
Hola.
No entiendo estos 3 ejercicios me los podrían explicar.
Muchas gracias por vuestra atención me ayudáis un montón a la hora de resolver me las dudas.
Ahí le envió la foto de los 3 ejercicios:
-
Hola! He intentado hacer este ejercicio pero no me coincide con el resultado, alguien podría ayudarme?
-
Buenos días, ¿
 me podrían resolver el ejercicio 11? Es que tengo dudas de cómo plantearle.
me podrían resolver el ejercicio 11? Es que tengo dudas de cómo plantearle.Muchas gracias.


Breaking Vlad
el 8/1/20se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
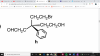
Buenas! Tengo una duda sobre esta molécula. Necesitaria saber la numeración (orden de preferencia) y su configuración (si es R o S). Gracias!

Rafamad435
el 8/4/24Muy buena explicación me funciono de mucho.
-----------------------------
Trabajo en https://copisa.com.mx
-
Tengo un duda. En una oposición de Química me ha salido esta pregunta: "Nombrar [Co(NH3)5 H2O]Br3"
La respuesta que di yo fue Bromuro de acuopentaminocobalto(III). Sin embargo, el Tribunal me la ha dado incorrecta dando como correcta la opción Tribromuro de acuopentaminocobalto(III). Es correcto?
-
Tengo dudas con la resolución que he puesto. Las dos últimas sé que propanal es CH3-CH2-CHO, pero no sé qué poner en el producto resultante.
VOY A RESUBIRLO A VER SI SE ME RESPONDE LA DUDA (no son mayúsculas de queja, son de que se vea la duda)
-


Jerónimo
el 23/12/19La [Cl-] existente en la disolución es 0,01 M.
Para prevenir que la precipitación se produzca se tiene que cumplir [Ag+][Cl-] sea menor que Kps, en este caso 1,77.10-10
[Ag+]0,01=1,77.10-10 [Ag+]=1,77.10-8 M
La concentración máxima de Ag+ sin complejar es 1,77.10-8, lo cual significa que prácticamente todo el Ag+ (0,1M) estará unido al NH3 formando el ión complejo Ag[(NH3)2]+.
Ag+ +2NH3-------->Ag[(NH3)2]+ Kf=1,6.10+7
A partir de la expresión de la cte de formación del complejo se puede calcula la concentración de NH3 libre .
Kf=[ Ag[(NH3)2]+ ] /[Ag+][NH3]² 1,6.10+7 =0,1/(1,77.10-8 [NH3] [NH3]= 0,59 M
A esta concentración de amoniaco hay que sumarle la cantidad que se ha consumido en la formación del complejo 2x0,1 = 0,2 M
[NH3] total = 0,59+0,2=0,79 M

Rafamad435
el 8/4/24Gracias por la ayuda me sirvio por tener un ejercicio similar.
-----------------------------
Trabajo en
https://copisa.com.mx