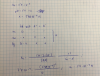-
Hola a todos.
Una duda con la constante de equilibrio.
Si Kc depende de la relación estequiométrica elegida, cómo elegir la buena? Me explico, si me dan la Kc de disociación del NH3 y no me dan la reacción, ¿cómo sé a cual de estas se refiere?
2NH3 <-> N2 +3 H2
ó
NH3 <-> 1/2 N2 + 3/2 H2
Gracias!!😊
-
El l-131 es utilizado en medicina para tratar del hipertiroidismo, ya que, al desintegrarse,destruye células de la tiroides. Si a un paciente se le suministra una dosis de 4g y el periodo de semidesintegración es de 8 días, ¿cuánto tiempo ha de transcurrir para que quede menos de 0,5g? ¿ Y menos de la milésima parte? Me podrían ayudar con este problema. Gracias


Breaking Vlad
el 17/1/20se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)

Martin
el 18/1/20En la imagen te va el desarrollo del ejercicio, primero puedes sacar la constante de semidesintergracion de ahi resuelves ambos ejercicios, si no igual hay otra forma de desarrollar la primera pregunta que te lo pondre abajo de la imagen:
4gramos -----------> 2gramos ------------> 1gramo ------------> 0.5gramos
8dias 8dias 8dias
esto quiere decir que cada 8dias se reduce a la mitad los gramos entonces cuando pasan ya 24 dias, se habrá reducido a 0.5g es por esto que cuando pasan mas de 24 dias uno quedan menos de 0.5g
-


Breaking Vlad
el 17/1/20Hola! Me encantaría ayudarte, pero no respondo dudas universitarias que no tengan que ver específicamente con los videos que ya he grabado como excepcion. O de otras asignaturas que no sean matemáticas, física y química. Lo siento de corazón… Espero lo entiendas
Ojalá algun unicoo universitario se anime a ayudarte (de hecho lo ideal es que todos los universitarios intentarais ayudaros los unos a los otros)
-
Hola buenas, la configuración electrónica del Escandio (Z=21) es:
1s22s22p63s23p64s23d1
Si el Sc perdiese un electrón (Sc+), cuál sería su configuración electrónica??
1s22s22p63s23p64s2
ó:
1s22s22p63s23p64s13d1
Yo creo que es más bien la primera... pero me gustaría comprobarlo.
Gracias
-
Que elementos pueden ser utilizados para sustituir al rodio? Abaratando costos, agilizando su obtención, produciendo en masa, un material o materiales aleados que puedan ser una alternativa al uso del rodio.
-
Hola, ¿Alguien me podría ayudar con este ejercicio? Mil gracias!!!
El hidrógeno se puede obtener mediante una reacción homogénea en fase gaseosa: monóxido de carbono más agua para dar dióxido de carbono mas hidrógeno. La constante de equilibrio de tal reacción, a 986ºC, vale 0,63. Si partimos de 3 moles de monóxido de carbono y 1mol de agua, la presión total en el equilibrio a dicha temperatura es de 2 atm. Calcular los moles de hidrógeno que existen en equilibrio.


Breaking Vlad
el 17/1/20se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)

Martin
el 17/1/20Te recomiendo que veas este video:
https://www.beunicoos.com/quimica/equilibrio-quimico/constante-de-equilibrio/equilibrio-quimico
-
Buenos días!
Informándome sobre la Química Supramolecur para realizar este Máster en Química, encontré un artículo sobre el "Proyecto Proteoma Humano". ¿Qué opináis sobre este proyecto internacional?