-
Calcular como preparar 50 mL de NaCl 0,9% a partir de NaCl comercial (sólido)


Jerónimo
el 12/9/19Si no te ha quedado claro te recomiendo te estudies el tema de como expresar una concentración o veas los vídeos relacionados.
Si quieres preparar una disolución 0,9% p/v , significa que en 100ml de disolución habrá 0,9 gramos de soluto. Si queremos preparar 50 ml, lógicamnete habrá que coger la mitad (0,45 gramos de soiuto).
-
Os agradecería que le echarais un vistazo al apartado c. del adjunto ejercicio. No estoy seguro ni del resultado ni de la denominación que doy a los componentes (vol?, masa molar?). Además, el resultado que me da el libro (un solucionado que he encontrado en internet) es de 22,4 mL de O2, y no los 16 mL como yo he calculado.. Un saludo.
-
¿Se podría, de alguna manera, expresar la entropía en J/°C? De forma que x cantidad de J/K sean equivalentes a y cantidad de J/°C, o sea, convertir las unidades.
Entiendo que la tecera ley de la termodinámica está planteada de forma arbitraria para un sólido puro y cristalino a 0K, pero supongo que se puede convertir la unidad de alguna manera.


Jerónimo
el 8/9/19No existe equivalencia porque la relación entre ºC y ºK es una suma , pero lo fundamental no es eso, sino que en el cálculo de la entropía tienes que considerar la escala absoluta de temperatura , siendo entropia cero en el cero absoluto de T (0ºK).
Imagínate que calcularas la entropía a 0º C , saldría una entropía cero, cosa que sería absurda.
-
 3ESO. Ley de J.L.Proust vs Ecuación química.
3ESO. Ley de J.L.Proust vs Ecuación química.Hola buenos días. Os adjunto un ejercicio de respuesta múltiple que acabo de hacer. Creo que todas las respuestas son correctas, salvo la b [ejercicio resaltado en color amarillo, cuya respuesta válida, salvo error, sería 32 g de H2O, puesto que con 32 g de O2 sólo reaccionan 4 g de H2]. El ejercicio lo he dejado mal a propósito para que veáis que lo he intentado, sin éxito, hacer mediante una ecuación química.
Por favor, para evitar estos errores, ¿me podéis orientar sobre cuándo (en general) se debe utilizar el procedimiento de reacción química?


Breaking Vlad
el 7/9/19Hola Jose Antonio,
en ese ejercicio, el "problema" es que te dan los dos reactivos, entonces primero se debe comprobar si hay limitante o no.
Por norma general, yo diría que en estos ejercicios, si te dan, más de una, sustancia, ya tendrás que usar la reacción, y calcular limitante y exceso.
Un saludo,
Vlad
-
3ESO. 2 Procesos químicos o físicos. Hola, tengo un lío con esto. Gracias por vuestra ayuda.
1. Preparar café. Apostaría por proceso químico, pero no estoy seguro:
Echamos agua y café (por ej. molido de paquete) en la cafetera; lo ponemos al fuego el tiempo necesario hasta que hierva la mezcla.
El café molido desaparece (salvo los residuos del mismo que quedan en una parte de la cafetera). Al principio teníamos el H2O + café molido. Luego tenemos café líquido, unos residuos y H2O (g). En la composición de este café líquido sin duda sigue existiendo el agua pero... ¿que ha cambiado en la naturaleza del café inicial. Entiendo que el proceso NO es reversible.
2. Tostar el pan. Mi duda es similar al caso del café. En el caso del pan se produce una “combustión controlada” para no carbonizar la tostada. Pero me de la impresión de que parte del pan (la que queda crujiente y si quemar, en su caso) sigue siendo pan, aunque de características diferentes al inicial (con menos agua, imagino). ¿Es posible que aquí existea los dos procesos: físico y químico?


Breaking Vlad
el 6/9/19Hola José,
En el caso del café es ciertamente complejo. Se trata, a grandes rasgos. El café inicialmente tenía los mismos compuestos en su composición que al final, lo único que has hecho ha sido separarlos. Sin embargo, tal y como te digo, es complejo, ya que el café tiene muchos componentes, y algunos se disuelven por vía física (como la cafeina, azúcares, etc,...) Mientras que otros compuestos, como sales, ácidos, etc, que disocian en agua, se disuelven por vía química.
En cuanto a la tostación del pan, es indudablemente un proceso químico. Estás (a parte de eliminando agua por vía física) degradando moléculas y "quemándolas" tal y como dices de manera controlada. Es, en primer lugar un secado (físic) luego una deshidratación (química) y finalmente si se quema, sería una combustión.
Un saludo,
Vlad
-
El ejercicio es este: Se llena un recipiente con fosgeno, a la presión inicial de 1,0 atm, a la presion inicial de 1,0 atm y a 573k , y se alcanza el equilibrio: COCl2 (g) ↔ CO(g) + Cl2(g) . Cuya constante kp vale 1,0 x 10-3 atm . Calcula las presiones parciales y la presión total en el equilibrio. Lo que hice fue realizar la tablita donde coloco la presión inicial, del proceso y en el equilibrio, lo que me da en el equilibrio, es lo que pongo en la ec. de Kp, o sea la presión de los productos sobre los reactivos, elevado a su coef. estequiométrico, de ahí obtuve una ecuación de segundo grado, halle dos raices y una de ellas positiva es la que utilice para sustituir x, creen que está bien así? podrían ayudarme??
-
El problema es el siguiente
"El aire cuyo volumen especifico es de 0.8448 m3/Kg se encuentra a 21° c, encuentre la presión considerando qué es un gas ideal"
Necesito ayuda para resolverlo :(


Bertuline
el 5/9/19Tu tienes la ecuacion para gases ideales PV=RT para ejercicios donde no te estan dando la los moles de la ecuacion clasica PV=nRT, ademas, la R de ambas ecuaciones es distinta, ya que en este tipo de ejercicios se utiliza la R del aire, que es 286.9 (J/kg K).
El problema en cuestion se resolveria colocando tu valor de volumen especifico (0.8448 m3/kg) y tu temperatura (21°C), esta ultima expresada en grados kelvin, es decir 294.15K y la R de tu gas ideal (aire), que es 286.9 (J/kg K); todo esto en la ecuacion PV=RT.
P * 0.8448m3/kg =286.9J/kgK * 294.15K
Despeja la presion y llegaras a tu resultado. -
Buenas tardes, necesito ayuda:
La siguiente reacción se utiliza valoraciones redox para determinar la concentración de iones sulfito en aguas residuales: SO32- (aq) + MnO4- (aq) SO42- (aq) + Mn2+ (aq).
La tengo ajustada pero este apartado no sé como resolverlo:
Al analizar cierta agua residual se encuentra que 25mL de agua consumen en su valoración 31,46mL de una disolución 0,02237 M de KMnO4. Calcule la concentración de SO32- que hay en el agua.
-
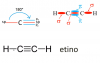
Tengo una duda y estaria agradecido si me dan una mano. En un examen me hicieron esta pregunta: cual es la hibridacion de un atomo que presenta dos legames sigma y dos legames pi, el atomo no tiene ninguna pareja de electrones libre.
a)sp2
b)sp4
c)sp3
d)no es hibrido
e)sp