-
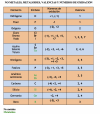
 3ESO, valencias, nos. oxidación, metales, metaloides, no metales.
3ESO, valencias, nos. oxidación, metales, metaloides, no metales.Hola, sinceramente no sé si es mucho pediros que le echeis un vistazo a las dos tablas adjuntas que he preparado. Lo que necesito saber es si, de manera aceptable, representan las valencias y números de oxidación más usuales para la realización de ejercicios. He mirado algunas fuentes [mi libro, en primer lugar, y varias webs en particular] y a veces difieren. No exactamente en que el contenido sea diferente, sino que unas escriben, por ejemplo, X valencias, o Z números de oxidación, y otras ponen el doble, por ejemplo, de números de oxidación. Incluso algunas pasan de los números de oxidación, o las valencias, y viceversa. Seguro que todo tiene una explicación. Muchas gracias de antemano.
-
¿La fórmula de un compuesto químico es un modelo formal o mental?


Jerónimo
el 18/9/19No entiendo lo de modelo mental.
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espac
-
Hola, se dice sobre el radio de Van der Walls : "El radio de Van der Waals puede establecerse a partir de las interacciones entre átomos vecinos en cristales y a partir de los volúmenes críticos en los gases." pero si las fuerzas de van der walls son entre dos moléculas, la distancia de equilibrio de esta unión no representa radio atómico no?? representaría el radio del agregado formado al unirse las moléculas por esas fuerzas no?
Este gráfico representa la distancia de enlace covalente, y aquí si se puede definir el radio atómico, pero esto nos seria el radio de van der walls no?
Más información: http://www.educaplus.org/elementos-quimicos/propiedades/radio-van-der-waals-batsanov.html
Copyright © Educaplus.org

Breaking Vlad
el 17/9/19Hola Teresa,
las fuerzas de Van der Waals son debidas a la interaccion entre los electrones de un átomo con los electrones y protones de otro. No está directamente relacionado con moléculas.
Por ejemplo, entre el He, Ne, Ar, Kr,.. a medida que bajamos los puntos de fusión y ebullición aumentan, porque las interacciones de Van der Waals son más intensas, sin embargo, los gases nobles no están formando moléculas.
Lo que sucede en las moléculas es que tenemos un conjunto de átomos enlazados, cada uno con su "zona electrónica de interaccion" y por lo tanto, en conjunto, interaccionan con otras moléculas también.
Espero haber aclarado un poco tu duda.
-
en la reacción de combustión del nonano (C9H20) da origen al dioxido de carbono + agua; ¿cuantos ml de dióxido de dioxido de carbono en c.n. pueden producirse a partir de 5 ml del nonano, liquido?. La densidad del nonano líquido es 0,70 g / ml a 0°c.
Por favor ayuda :(























