-
Respecto al apartado a) lo he tenido bien pero lo he razonado de otra manera. Que explicación podría añadir en mi razonamiento?
O debo ponerlo como la solución pone, con una tabla de los números cuánticos?
-
por que el F- tiene mas radio Na+
ya que mi razonamiento ha sido totalmente el contrario:
Al ser especies isoelectronicas +, como Na tiene mas Z y se encuentra en un nivel superior pues tendra mas radio


Vicky
el 11/6/19Hola Paula,
Las especies isoelectrónicas tienen el mismo número de electrones. Además, como bien dices, Na tiene mayor Z que F. Esto quiere decir que Na tiene mayor número de protones en el núcleo. Más protones e igual cantidad de electrones implica mayor carga nuclear efectiva. ¿Cuál de los dos iones atraerá con más fuerza a los electrones que conforman su capa de valencia? ;)
-
es correcto decir acido iodico o yodico?


Vicky
el 11/6/19Según la RAE, es más correcto decir yodo y sus variantes (ácido yódico) que iodo porque, aunque es más cercano al origen etimológico de la palabra, es menos frecuente.
En inglés es iodic acid, manteniendo la i original, porque el elemento I es iodine.
Pero vamos, que para evitar disputas innecesarias en selectividad, yo pondría ácido yódico y listo (desde mi humilde opinión como alumna xD)
-
Buenas, podrían corregirme este ejercicio?
Ya que la solución viene dada por fórmulas y no se por tanto dónde está mi fallo
Mi profesor no quiere que lo hagamos por fórmulas.
Gracias
No encuentro el fallo y me estoy volviendo CRAZY. podrian mirarmelo? graciasss



Vicky
el 11/6/19Hola Paula,
Así de primeras en el a) parece que has puesto en negro (que imagino que es el enunciado) que tienes que preparar 20 L de una disolución NaOH a partir del otra comercial, pero al empezar los factores de conversión poner 20 mL. Puede ser que vaya por ahí?
Y como petición personal, si puedes subir las imágenes en vertical pls que me estoy dejando el cuello xD
Inténtalo otra vez a ver si era eso y nos dices :)
-
Buenas, como cálculo el apartado b) SIN fórmula?
Siempre lo he hecho:
1. Escribo y ajusto la reacción en neutralización
2. Averiguo los moles de la disolución que hay que neutralizar, y a partir de aquí por estequiometria averiguo los de la disolucion de la que quiero averiguar el volumen.
3. Conociendo la molaridad y los moles ya puedo conocer el volumen.
El problema es que la reacción que tengo que neutralizar no la tengo clara ya que NaOH + KOH existe NaK o KNa? No suena bien
Gracias


Vicky
el 11/6/19Hola Paula,
Como siempre lo has hecho está perfecto, y eso no es utilizar fórmulas, es deducir :)
Tu duda es si NaOH y KOH dan reacción entre ellos y la respuesta es no, no reaccionan. Lo que hacen es soltar OH- los dos, así que será necesario echar HCl para contrarrestar tanto el NaOH como el KOH :)
-
Tengo una duda con el siguiente ejercicio:
-Indica si son verdaderas o falsas estas afirmaciones:
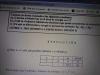
a) El radio del ión I- es mayor que el del átomo de I.
Yo habría dicho que no, porque el átomo I al pasar a anión I- tiene propiedades de gas noble, además de que, bajo los propiedades del radio atómico, este disminuye al avanzar en un periodo debido a que aumenta la carga nuclear y la nube electrónica es atraída con mayor intensidad y aumenta al bajar en un grupo debido a que, aunque aumente la carga nuclear, también aumenta el número de capas electrónicas, por lo que el radio aumenta.
La solución que se ofrece es:
"Los dos tienen el mismo número atómico Z=53, pero el anión tiene 1 electrón más que el átomo de I, lo que implica una mayor repulsión entre los electrones, por lo que aumenta el tamaño y, por lo tanto, el radio es mayor."
¿Alguien me puede aclarar esto?


Vicky
el 11/6/19Hola Iván,
Es cierto que el yodo, al captar un electrón, se hace más estable por alcanzar la configuración de gas noble. Sin embargo, el tamaño está relacionado con la carga nuclear efectiva: a mayor carga nuclear efectiva en un mismo elemento, menor tamaño.
El ion I- tiene 1 electrón más que el I, con exactamente la misma cantidad de protones en el núcleo en ambos. Ese nuevo electrón del I- se encontrará con el apantallamiento de toooodos los electrones que ya tenía el átomo I, por lo que rondará un poco más lejos del núcleo de lo que lo hacían el resto de electrones de valencia en I.
El esfuerzo que hace el átomo invirtiendo la carga nuclear efectiva en atrapar un electrón se compensa con el hecho de que alcanza la configuración electrónica más estable (gas noble), pero eso no implica que el radio sea más pequeño :)

Iván
el 11/6/19Ah vale. Entonces eso ocurrirá siempre que nos den un átomo y su aniónmás estable, ¿No? Y, si he entendido bien, si nos dan un átomo y su catión más estable se produciría lo contrario, el radio del catión sería menor que el del átomo.
¿Esto se aplica también a las otras propiedades periódicas?
-
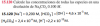 Yo plantee el ejercicio de la siguiente manera
Yo plantee el ejercicio de la siguiente maneraNa2CO3 --> 2Na+ + CO3-2
Por cada 0.100M de Na2CO3 se producen => 0.200 M Na+ y 0.100M CO3-2
CO3-2(ac) + H2O(l) <==> HCO3- (ac) + OH- (ac)
I(M) 0.100 ---- ------ ----
C(M) -x -x +x + x
R(M) 0.100 - x ----- x x
Kb= 1.8*10-4 = x*x/(0.100-x)
-(1.8*10-4)x + 1.8*10-5 = x*x => x*x + (1.8*10-4)x - 1.8*10-5
x =( -(1.8*10-4) +- Raiz( (1.8*10-4)*(1.8*10-4) -4(1)( - 1.8*10-5)))/2 = x = 4.155*10-3
HCO3-(ac) + H2O(l) <==> H2CO3 (ac) + OH- (ac)
I(M) 4.155*10-3 ---- ------ 4.155*10-3
C(M) -x -x +x + x
R(M) 4.155*10-3 - x ----- x 4.155*10-3 + x
Kb = (H2CO3)(OH-)/(HCO3-)
No tengo la Kb pero se que
H2CO3 (ac) + H2O(l) <===> HCO3-(ac) + H3O+ (ac)
Ka =(HCO3-)(H3O+)/H2CO3 =4.3*10 -7
Kb=((H2CO3)(OH-)/(HCO3-))*((H3O+)/H30+)) = Kw/Ka = 1*10-14/4.3*10-7 =2.33*10-8
Kb= (4.155*10-3 + x)x/(4.155*10-3 + x)=2.33*10-8 => aproximo y me queda x(4.155*10-3/4.155*10-3) = 2.33*10-8
x= 2.33*10-8
nota: La aproximación la hago es porque el valor de x va a ser muy pequeño en comparación a el 4.155*10-3 teniendo unmargen de error menos al 5%
pH + pOH- = 14
pOH = -log(OH) = -log(4.155*10-3)=2.38
pH = 14 - 2.38 = 11.62
(H+) = 10-(ph) = 2.398*10-12
Me queda que las concentraciones son:
(Na+) = 0.200 M
(H2CO3) = 2.33*10-8
(H+) = 10-(ph) = 2.4*10-12
(HCO3-)=(OH-) = 4.155*10-3
Creo mi procedimiento esta bien pero no me dan los resultados de la guia. ¿que hago mal?
-
Buenos dias ! Necesito ayuda con este ejercicio.
El amoniaco (NH3) se descompone en hidrógeno (H2) y nitrógeno (N2). Determina los gramos de hidrógeno que se obtienen a partir de 40 gramos de amoniaco
gracias

Vicky
el 10/6/19Hola Ángel,
Es un ejercicio muy típico del temario de Estequiometría, mírate los vídeos, intentalo y si sigue sin salirte nos pones en el foro cómo lo has hecho tú para que podamos ayudarte. Mucho ánimo!
-
en el apartado a pensaba que la cantidad sin descomponer era la cantidad inicial de moles menos la cantidad de moles en equilibrio pero el resultado no me da. Por tanto como averiguo la cantidad que queda sin descomponer


Vicky
el 10/6/19Hola Paula,
La cantidad sin descomponer es lo que queda del reactivo inicial en el equilibrio. Si tú metes un trozo de CuO en un reactor, dejas que se alcance el equilibrio y entonces miras otra vez, como es un equilibrio, el trozo de CuO no ha desaparecido, pero sí se ha hecho más pequeño. Eso es la cantidad que no se ha descompuesto.
Para resolver tu ejercicio, una vez tienes la cantidad de O2 en el equilibrio (x), puedes sustituir en el valor de CuO en el equilibrio y listo, tienes los moles de CuO :)
-
Un amigo me ha pasado este ejercicio para ver si podía ayudarlo y realmente no tengo muy claro por qué se resuelve así... Si alguien pudiese darme una explicación algo más clara lo agradecería muchísimo. Me pierdo sobretodo en el paso de la resta del peso del compuesto y el residuo y en la parte en la que divide entre la masa molar del CO2 + H2O


Breaking Vlad
el 12/6/19Hola Marta,
el proceso que han seguido es básicamente hallar los moles de CO2 y H2O que hay en la diferencia de masa (sabiendo que, por la estequiometría, habrá moles iguales de cada especie).
Una vez tienes los moles de CO2 (por ejemplo) calculas los de NaHCO3, y de ahí la masa. ¡Calculas entonces el porcentaje y listo!
Lo único es que ellos lo han resuelto con un factor de conversión.
Un saludo,
Breaking Vlad