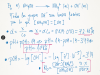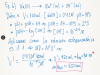-
Ordene razonadamente los siguientes sólidos en orden decreciente de su punto de fusión: CaF2,
CaBr2 y LiF. ¿Cuál de las tres especies es menos soluble en agua? Justifique la respuesta.Dados los elementos A (Z=20) y B (Z=35). Razone qué tipo de enlace se podrá formar entre A y
B y cuál será la fórmula del compuesto resultante.
-
POR FAVOR TENGO MAÑANA SELECTIVIDAD. AYUDA
Respecto al apartado a)
1. Partiendo de la base de que NO ES UN ACIDO/BASE FUERTE ya que tiene constante de disociación, pienso que como viene resuelta en internet no debería estar correcto, reaccionaria con agua dando amoniaco y ión hidroxilo. Por tanto la reacción que viene escrita estaría mal y la mía bien?
2. A los dos, a internet y a mí, nos da la Kb lo mismo. Sin embargo a mí no me da el mismo pH ya que en su reacción hay disociados OH y en la mía H3O+. Ayuda
RESPECTO AL APARTADO B)
No veo mi fallo ni se dónde podría estar. Podrían ayudarme?
UN MILLÓN DE GRACIAS POR AGUANTARME


Francisco Javier Tinoco Tey
el 13/6/19La notación científica desde que existe una tecla en la calculadora como ENG que te permite poner los decimales en notación científica hace que, entre los nervios que tienes para mañana, puedas dudar de tus resultados. Esta correcta la calculadora y las demás operaciones que hecho tanto el resultado de la calculadora tuyo. Mañana en el examen te recomiendo que uses la tecla ENG para pasar los decimales a notación científica, o incluso puedes dejarlos tal cual. El objetivo principal es que lo que pongas estés segura, no te agobies y ya verás como mañana te irá bien. Animo y suerte!!!
-
Necesito ayuda con esta pregunta:
Calcule la entalpía de formación estándar del pentóxido de dinitrógeno a partir de los siguientes datos, 2 NO(g) + O2 (g) → 2 NO2 (g) ∆H0 r = -114.1 kJ ,
4 NO2 (g) + O2 (g) → 2 N2O5 (g) ∆H0 r = -110.2 kJ , y de la entalpía de formación del óxido nítrico, NO (∆H0 f(NO(g))= 90.25 kJ/mol)
-
En un estudi cine` tic de la reaccio´ 2 A (g) 4 B (g)+C (g), a una temperatura determinada, s’han
obtingut les dades segu¨ ents:
[A] (mol · L−1) 0,08 0,05 0,01
v (mol · L−1 · s−1) 1,28 · 10−3 5,00 · 10−4 2,00 · 10−5
Determineu:
a) L’ordre de reaccio´ .
b) La concentracio´ del producte C quan han transcorregut 30 minuts des que han comenc¸at a reaccionar
els 0,08 mol/L del reactiu A.
c) Per a aquesta reaccio´ es proposa el mecanisme segu¨ ent:
1a etapa (lenta) A B+F
2a etapa (ra` pida) F G+2 C
3a etapa (ra` pida) F+G 2 B
4a etapa (ra` pida) A+C B+F
Indiqueu la molecularitat de cada etapa i justifiqueu si aquest mecanisme pot ser compatible amb la
llei de velocitat experimental.


Breaking Vlad
el 12/6/19Hola, te recomiendo este vídeo:
Velocidad de reacción | Cinética química
A partir de ahí, intentalo y comentanos las dudas que te salgan en el proceso, nosotros no resolvemos vuestros ejercicios, sino queos ayudamos a resolverlos por vosotros mismos.
-
Siento tantas preguntas pero tengo selectividad el jueves y estoy muy nerviosa.
Que fallo tengo en el apartado b)? No lo encuentro
Gracias

Iván
el 11/6/19Yo también tengo que ir el jueves a química jajaj
Lo que se produce en el apartado b) es el efecto ión común.
Tienes que se añaden 0,2 M de iones Ca2+ por lo que la Ks te tendría que quedar algo así:
Ks= (s+0,2) • (2s)2
Aquí como 0,2>>>s podremos no tener en cuenta s y nos quedaría algo así:
Ks= 0,2 • 4s2
El dato de la Ks ya lo tenemos, Ks=3,9x10-11 entonces ya podemos sacar s:
s=√(3,9x10-11 / 0,2 • 4 ) = 6,98x10-6 M (mol/l)
Y como [F- ] = 2 • s = 2 • 6,98x10-6 = 1,396x10-5 M
Tu problema ha sido que has hecho Ks = 0,2 • 4s3 y claro luego has hecho raíz cúbica.
-
Tiene problemas para obtener los puntajes requeridos en IELTS, GRE, TOEIC, TOEFL, PET, FCE, CAE, CPE, BEC, YLE, KET, BULATS, ILEC, ICFE CELTA, CERTIFICADOS DE AUTODESK DE DELTA ESOL y todos los Certificados sin tomar un examen
¿Necesita el certificado de Ielts con urgencia del Consejo Británico o un funcionario de IDP sin tomar el examen? ¿Quieres mejorar tu puntuación de banda para Ielts o Toefl? En David Doc's podemos ayudarlo a obtener el certificado original de todas estas pruebas sin tomar el examen. Somos un grupo de profesores y examinadores que trabajamos en varios centros como British Council, IDP centers, Ets, Gmat Etc ... y nos hemos unido para formar una amplia organización con el único interés de brindar servicios confiables para todos nuestros clientes. En la documentación. y consulta de viaje. Nuestro Grupo de personal se dedicará a su misión y tratará cada caso como muy importante.
Nuestros servicios
proporcionamos un certificado oficial con registro en la base de datos y sellos reales del centro para los clientes interesados en obtener el certificado sin tomar el examen. Si ya tomó el examen y hace menos de un mes que tomó el examen, podemos actualizar los resultados obtenidos en su prueba anterior para proporcionarle un nuevo certificado con los resultados actualizados para que pueda seguir sus procedimientos de relaciones públicas sin ningún riesgo.
Solo proporcionamos certificados originales con posibilidades de verificación en línea. Usted está garantizado al 100% haciendo esto con nosotros, ya que el certificado que obtiene es 100% legal y se acepta en cualquier lugar sin ninguna duda. Los clientes interesados en obtener el certificado deben comunicarse con nosotros a través de los datos de contacto que se detallan a continuación. Los pagos y los precios se analizarán al responder a este anuncio.
Póngase en contacto con nosotros directamente para obtener más información sobre nuestros servicios.
Detalles de contacto:
Correo electrónico: daviddocumentconsultant@yahoo.com
sitio web: davedocument.com
whatsapp: +1 240-366-0978
¿También ha estado buscando un pasaporte, número de seguro social (SSN, por sus siglas en inglés), una licencia de conducir, un certificado de nacimiento, un certificado de nacimiento, un diploma o cualquier otro documento? ¿O tal vez comprar pasaporte para un documento australiano o canadiense? ¿Es un pasaporte falso o real, número de seguro social, licencia de conducir, DI, certificado de nacimiento, diploma o cualquier otro documento? "No busque más", su curiosidad lo ha llevado al lugar correcto ya sea que tenga su sede en Estados Unidos, Australia, África, Asia o Europa, siempre que tenga un apartado postal válido o una dirección de la casa, nos aseguraremos de que el problema haya terminado. . Para obtener más información, contáctenos (daviddocumentconsultant@yahoo.com) para obtener más orientación.
Solo ofrecemos pasaportes registrados de alta calidad de base de datos, licencias de conducir, tarjetas de identificación, sellos, visas, diplomas escolares, permisos de trabajo, certificados de nacimiento, certificados de matrimonio, certificados de muerte, tarjetas verdes, tarjetas de crédito, recibos bancarios y otros documentos para Número de países como: Estados Unidos, Australia, Bélgica, Brasil, Canadá, Italia, Finlandia, Francia, Alemania, Israel, México, Países Bajos, Sudáfrica, España, Reino Unido, Japón, China y ¡Esta lista no está completa!
TODOS LOS DOCUMENTOS DE CALIDAD
Los destacados y únicos productores de documentos de viaje y de identidad de REAL y FAKE en todo el mundo, como pasaporte, visa, permiso de residencia, tarjeta de identificación, licencia de conducir, certificado de nacimiento y otros documentos como tarjetas de seguridad social, diploma, IELTS y muchos más ...
Producimos documentos registrados en la base de datos Real que se utilizan legalmente y pasan todas las exploraciones del aeropuerto y las máquinas de verificación de datos. Cada vez que se verifiquen estos documentos Reales en el sistema, toda la información del titular se mostrará válidamente haciendo que el documento sea real y aceptable, y el titular puede utilizarlo legalmente sin ningún problema porque está registrado bajo el reconocimiento de las autoridades en el sistema.
Información de contacto
Solo contáctanos vía email.
Para cualquier consulta envíe un correo electrónico a:
Correo electrónico: daviddocumentconsultant@yahoo.com
sitio web: davedocument.com
whatsapp: +1 240-366-0978
Palabras clave
Tarjetas de Canadá
Estados Unidos Tarjetas
Tarjetas de estudiante
Tarjetas Internacionales
Tarjetas privadas
Certificados de Adopción
Certificados de Bautismo
Certificados de nacimiento
Certificados de defunción
Certificados de Divorcio
Certificados de matrimonio
Certificados personalizados
Diplomas de escuela secundaria
G.E.D. Diplomas
Diplomas de escuela de hogar
Titulos universitarios
Títulos universitarios
Certificados de habilidades comerciales
Seguridad Social
Validar el número de SSN
Búsqueda de licencia de conducir
Productos espia
Cambiadores de voz
Dispositivos de escucha
Tinta invisible
Consulta de registro de DMV
Verificación de antecedentes
Investigar a alguien
Solo contáctanos vía email.
Para cualquier consulta envíe un correo electrónico a:
Correo electrónico: daviddocumentconsultant@yahoo.com
sitio web: davedocument.com
whatsapp: +1 240-366-0978
-
como se cuando un enlace covalente molecular es puro y cuando no?
gracias

Vicky
el 11/6/19Una sustancia que está hecha sólo con enlaces covalentes es muy difícil de romper, como es el diamante (3D) o el grafito (2D). Las sustancias moleculares son aquellas que, aunque los enlaces entre átomos sí que son enlaces covalentes (también muy difíciles de romper), la molécula en sí no está unida a otras moléculas por enlaces covalentes, sino por fuerzas débiles (tipo Van der Waals, o puentes de H, o dipolo-dipolo, todo depende de cómo sea tu molécula).
Hay muy pocas sustancias covalentes puras, y la enorme mayoría son moleculares.
Para saber cual es cual, recurriría a mirar/deducir las propiedades :)