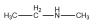-
Hola, no se que hago mal pero no me da el resultado ninguna de las opciones (la verdad es que no entiendo muy bien a que corresponde cada dato) Muchas gracias

Paula
el 13/6/19Hola, lo he estado intentando pero sigue sin salirme no se que hago mal.
Una pregunta ¿ al variar los ml de disolución varia la concentración de esta? es decir sin al principio con 250 ml tengo una concentración de 0,08M , si yo tomo después 25 ml de esa disolución la concentración seguirá siendo 0,08M
-


Breaking Vlad
el 10/6/19Hola Paula,
lo primero que debes hacer en este tipo de reacciones es escribir la reaccion que estás haciendo:
NaOH + H2C2O4 -> Na2C2O4 + H2O
y entonces ajustarla.
Luego con esos 16 mL 0,05M calculas los moles de oxálico, y según la estequiometría que te ha quedado en la reaccion, sacas los moles de NaOH y la concentración de NaOH
luego, con un procedimiento equivalente calculas la concentracion de HCl
-


Breaking Vlad
el 10/6/19Hola Paula,
imaginate simplemente que tienes una sustancia que se disuelve 1g en 1L de agua.
Si tienes 1L de agua, se disolvera un gramo. Si empiezas a añadir más y más agua, se disolverá más. (si añades 1L, tendrás 2L en total: se te disolverán 2g.)
Pues eso es básicamente lo que quiere decir. que se te disolverá más
-
Buenas, podrían corregirme este ejercicio?
Ya que la solución viene dada por fórmulas y no se por tanto dónde está mi fallo
Mi profesor no quiere que lo hagamos por fórmulas.
Gracias

Iván
el 9/6/19Lo primero que tienes que calcular es la Molaridad del NaOH comercial (que ya la has calculado en el apartado anterior pero que podrías volver a calcular de la misma manera).
Una vez tienes M, puedes sacar los moles de NaOH a partir de esos 5mL que se van a neutralizar:
n= 19 mol/L x 0,005 L = 0,095 mol NaOH
Con los moles de NaOH puedes sacar los moles de H2SO4 a partir de la relación estequiométrica:
0,095 mol NaOH x (1 mol H2SO4 / 2 mol NaOH) = 0,475 mol H2SO4
Y por último el V lo sacas a partir de estos moles y el dato de la molaridad (0,25M):
V= 0,475 mol / 0,25 M = 0,19 L
-
Buenas tardes,
Se podría nombrar de las dos formas siguientes?
-etil metilamina
-propan-2-amina
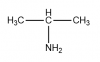
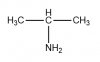
El compuesto
CH3CH2NHCH3
-
Buenas tardes,
Podrían mirar si he expresado correctamente el factor de conversión? (Quiero llegar a miles de NaOH) independiente de los números y el cálculo.
Gracias


Breaking Vlad
el 10/6/19Hola Paula,
no te puedo confirmar si está correcto porque estos ejercicios con factores de conversión dependen mucho del enunciad, y sin saber qué te preguntan, y los datos que te dan, no puedo confirmar que esté bien.
Pero suponiendo que: lo primero sea la densidad, lo segundo %(m/m) y lo tercero masa molecular, entonces sí.
-
Por qué en la semireaccion de oxidación el peróxido de hidrogeno no se separa? Por qué ahí que ponerlo junto? Los peróxidos no pueden separarse?

Vicky
el 9/6/19El peróxido de hidrógeno (o agua oxigenada) es un compuesto covalente, no iónico. No se puede separar en iones, y es un caso especial en el que el oxígeno actúa con valencia formal -1 (cuando lo habitual es -2 o 0).
La estructura de Lewis es algo como H-O-O-H, así que la fórmula acortada es H2O2.
Espero que te sea útil esta explicación :)
-
En el apartado a) cuando me pide la molaridad, suponemos que es en un litro de disolución?
Ya que yo lo hago con factores de conversión y no puedo compararlo muy bien
Gracias

Vicky
el 9/6/19Hola Paula,
La verdad es que siempre que podamos evitar suponer, mejor, porque luego te ponen que por qué lo has hecho y es más difícil de explicar xD
Para preguntas como esta, lo mejor es empezar con el dato seguro, que es la densidad de la disolución comercial, e ir enlazando factores de conversión.