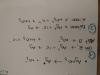-
-
¿Cuáles son las ecuaciones iónicas de:?
---- C2h5oh + c12h22o11
---- ch2cl + c6h5cooh
---- ch2cl + kno3
---- ch2cl + c12h22o11
Las busque en todas partes y no las consigo


Vicky
el 9/6/19Hola Ángel,
Tengo entendido que las ecuaciones iónicas son aquellas en las que se forman iones, y por ello tienen que contener en su fórmula compuestos iónicos.
De todos los compuestos que has puesto en las ecuaciones, tiene pinta de que el único iónico es el KNO3, que se disociará en K+ y NO3-. Por otra parte, el C6H5COOH entrará en equilibrio con su ion carboxilato, así que no sé si lo podrías considerar iónico o no, ya que no se disocia totalmente.
El resto parecen compuestos orgánicos que se caracterizan por estar unidos por enlaces covalentes. En otras palabras, que son moleculares y las fuerzas de interacción no son electrostáticas, sino tipo puentes de H y Van der Waals, así que no se disociarán sin más.
Espero haberte ayudado :)
-
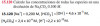 Yo plantee el ejercicio de la siguiente manera
Yo plantee el ejercicio de la siguiente maneraNa2CO3 --> 2Na+ + CO3-2
Por cada 0.100M de Na2CO3 se producen => 0.200 M Na+ y 0.100M CO3-2
CO3-2(ac) + H2O(l) <==> HCO3- (ac) + OH- (ac)
I(M) 0.100 ---- ------ ----
C(M) -x -x +x + x
R(M) 0.100 - x ----- x x
Kb= 1.8*10-4 = x*x/(0.100-x)
-(1.8*10-4)x + 1.8*10-5 = x*x => x*x + (1.8*10-4)x - 1.8*10-5
x =( -(1.8*10-4) +- Raiz( (1.8*10-4)*(1.8*10-4) -4(1)( - 1.8*10-5)))/2 = x = 4.155*10-3
HCO3-(ac) + H2O(l) <==> H2CO3 (ac) + OH- (ac)
I(M) 4.155*10-3 ---- ------ 4.155*10-3
C(M) -x -x +x + x
R(M) 4.155*10-3 - x ----- x 4.155*10-3 + x
Kb = (H2CO3)(OH-)/(HCO3-)
No tengo la Kb pero se que
H2CO3 (ac) + H2O(l) <===> HCO3-(ac) + H3O+ (ac)
Ka =(HCO3-)(H3O+)/H2CO3 =4.3*10 -7
Kb=((H2CO3)(OH-)/(HCO3-))*((H3O+)/H30+)) = Kw/Ka = 1*10-14/4.3*10-7 =2.33*10-8
Kb= (4.155*10-3 + x)x/(4.155*10-3 + x)=2.33*10-8 => aproximo y me queda x(4.155*10-3/4.155*10-3) = 2.33*10-8
x= 2.33*10-8
nota: La aproximación la hago es porque el valor de x va a ser muy pequeño en comparación a el 4.155*10-3 teniendo unmargen de error menos al 5%
pH + pOH- = 14
pOH = -log(OH) = -log(4.155*10-3)=2.38
pH = 14 - 2.38 = 11.62
(H+) = 10-(ph) = 2.398*10-12
Me queda que las concentraciones son:
(Na+) = 0.200 M
(H2CO3) = 2.33*10-8
(H+) = 10-(ph) = 2.4*10-12
(HCO3-)=(OH-) = 4.155*10-3
Creo mi procedimiento esta bien pero no me dan los resultados de la guia. ¿que hago mal?
-
Buenas tardes,
Necesito ayuda con un problema, es el siguiente.
Estudiamos la velocidad de la siguiente reaccion entre el magnesio y el acido clorhidrico.. Mg(s)+2HCL(aq)→MgCl²+H²(g).
Me preguntan que sucede en cada caso
a) si utilizamos acido clorhidrico muy diluido en lugar de acido clorhidrico concentrado
b) si enfriamos el tubo de ensayo que contiene los reactivos
c) si añadimos un catalizador


Vicky
el 9/6/19Hola Montse,
¿Es exotérmica o endotérmica? Creo que ahí está la clave para resolver la pregunta b).
Aparte, si añades un reactivo más concentrado, habrá más probabilidades de que se encuentren las moléculas de todos los reactivos, lo cual normalmente significa una reacción más rápida. Y un catalizador lo que hace es bajar la energía de activación de la reacción, por lo que las moléculas podrán pasar más fácilmente al "otro lado", lo que también suele significar un aumento de la velocidad de obtención de productos si estamos manteniendo las mismas condiciones que sin catalizador.
-
Necesito ayuda con el siguiente problema.
He resuelto la reaación redox en medio ácido pero no sé como continuar.
Un trozo de hierro que pesa 0.1568 g se transforma en Fe2+ (aq) y necesita para su valoración 26.24 mL de una disolución KMnO4. Calcule la concentración de la disolución KMnO4. Reacción:
Fe2+(aq) + MnO4 - (aq) -> Fe3+(aq) + Mn2+ (aq) (medio ácido)


Vicky
el 9/6/19Hola Sara,
Creo que el ejercicio lo que busca es que halles los moles de Fe2+ para hacer el cambio a los moles de MnO4- y con eso obtener la molaridad. Para ello, hace falta hacer el ajuste redox y luego utilizar los coeficientes estequiométricos para el cambio. Te dejo lo que he hecho yo (espero que esté todo bien :))
-
Buenas,
En estas reacciones que se producen en el cátodo de una cubeta electrolítica,
Mi profesor me dio la solución 1. Pero yo puedo quw es más correcta la reacción 2. Ya que en ánodo del 1 faltaría un H
Gracias