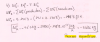-
Hola Unicoos
No sé si hay alguna diferencia entre la expresión de velocidad y "ecuación de velocidad" no sé si tengo mal el ejercicio, no encuentro las soluciones, alguien puede ayudarme a corregirlo por si lo tengo mal?
Muchísimas gracias
Pregunta A3.- A 25 ºC, transcurre la reacción elemental 2 NO (g) + O2 (g) → 2 NO2 (g).
a) Escriba la expresión de velocidad de reacción referida tanto a reactivos como a productos.
b) Formule la ecuación de velocidad de la reacción e indique el orden global de reacción.
c) Calcule la constante de velocidad si la velocidad de reacción es de 0,024 mol·L−1·s−1 para
[NO] = [O2] = 0,1 M.


Jerónimo
el 19/4/19La expresión de la velocidad tienes que colocarla de esta forma, adaptándola a tu ej.
Cinética - Ecuación de velocidad -
Hola, buenas tardes.
Tengo una duda respecto al ejercicio 41 que se muestra en la imagen, ¿cómo o a partir de qué fórmulas puedo calcular las cal. que me piden en el ejercicio?
-
Buenas tardes (o noches).
El punto es el siguiente: La mayor parte de los automóviles circulan con gasolina. La densidad de este combustible es 680 kg/m^3 y su poder calorífico 43160 kj/kg. Calcula la energía que se puede obtener de un galón de gasolina.
Y me dan la solución que es: 111*10^6 Joules
Necesito que por favor me ayuden con el procedimiento.
-
Buenas tardes , ¿cómo sería este problema? Se quiere preparar 50 mL de disolución de ácido sulfúrico 0,025M y se dispone en el laboratorio de una disolución de ácido sulfúrico que previamente se ha preparado disolviendo 5,5 mL de ácido sulfúrico comercial (d= 1,8 kg/L, R=98%) en 1 litro de disolución. ¿Qué volumen de la disolución previamente preparada hay que tomar para preparar la disolución 0,025 M de ácido sulfúrico?
Me da como resultado 69,5 pero no le veo sentido . Gracias de antemano
-
Hola Unicoos
Tengo dos dudas:
Es correcto decir como si fuese un equilibrio que si hay 0,2 mol de AgNO3 entonces se forman 0,2 mol de Ag+? (Subrayado amarillo)
Me podrían ayudar a sacar la concentración del Ag+ del apartado b) no entiendo muy bien cómo hacerlo
Muchas gracias
Se hace pasar una corriente de 1,5 A durante 3 horas a través de una celda
electroquímica que contiene un litro de disolución de AgNO3 0,20 M. Se observa que se desprende
oxígeno molecular.
a) Escriba y ajuste las reacciones que se producen en cada electrodo, indicando de qué reacción
se trata y en qué electrodo tiene lugar. Escriba la reacción molecular global.
b) Calcule los moles de plata depositados y la concentración de ion metálico que queda finalmente
en disolución.
c) Calcule el volumen de oxígeno que se desprende en este proceso, medido a 273 K y 1 atm. Datos: F=96485 C. R=0,082 atm.L.mol-¹.K-¹

-
Hola Unicoos.
No entiendo por qué aquí interviene la electrolisis del agua. Alguien me ayuda a no caer en estas trampas?
Muchas gracias


Jerónimo
el 16/4/19Has confundido el ácido clorhídrico con el electrodo ClO4-/ClO3-
El electrodo que tienes que usar en la disolución acuosa de HCl es H+/H2 que tiene un potencial de 0 V y compararlo con Sn+2/Snº= -0,14 V
El potencial H+/H2 es mayor y verifica la reducción y el Sn+2/Snº verificará la oxidación , por lo que si se verá atacado el Sn metálico