-


Breaking Vlad
el 24/11/19se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
Saludos desde Venezuela. Estoy muy agradecida por el apoyo que me han dado a través de este portal. Gracias a su ayuda y orientación pase de ser una de los peores a una de los cuatro mejores de mi salón en Química, tanto así que estoy eximida en la materia con un promedio perfecto de 20pts sobre 20pts. GRACIAS!!!!
-

Rafamad435
el 6/2/24Muy buena explicación sobre el problema.
--------------------------------------------
Te recomiendo visitar https://copisa.com.mx/
-
Estoy en el tema de disoluciones, mi libro no aplica las fórmulas típicas de disoluciones sino que lo hace por su cuenta, podríais explicarme por qué hace esas operaciones?
Si es que necesito aprender a interpretar operaciones decidme qué debería prepararme gracias

David
el 22/11/19A ver, por su cuenta no es exactamente, lo que hace es operar usando factores de conversión, y como en disoluciones se dan % en masa y volumen, pues siempre se suponen 100 gramos de disolución.
recuerda que las disoluciones se componen de soluto y disolvente, es decir, masa disolución= masa soluto + masa disolvente.

Alejandro
el 22/11/19Pero, por ejemplo, en el segundo entiendo lo de que se supone 100 g de disolución, pero por qué divide el disolvente entre el soluto? Sí la fórmula es m del soluto entre m disolución •100... Y por qué lo multiplica por 10g de soluto? Es que los 10 g de soluto representan el 100?

David
el 22/11/19es una proporción. Supuestos 100 g de disolución, 96 con de agua y 4 de glucosa. Si de dato tengo 10 g de glucosa, tengo que valerme de cada 100 g, 4 pertenecen a glucosa y 96 de agua, por eso sale 240 gramos. A los profes de química no les gustan las reglas de tres, pero con las conversiones es como que se planteara la regla de tres.
-
-
-


Breaking Vlad
el 24/11/19se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
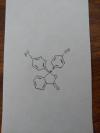
Hola, alguien tendrá una idea de donde puedo encontrar material sobre determinación de carácter ácido-base con este método?
-


Breaking Vlad
el 19/11/19se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-


Breaking Vlad
el 19/11/19se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)