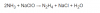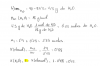-
Hola, ya hice una pregunta similar respecto a los hidruros.. ahora es el caso de las combinaciones del oxigeno con los halógenos, antes del nuevo orden de electronegatividad, el oxigeno, salvo con el fluor, con el resto de halógenos formaba óxidos, pero ahora se supone que todos los halogenos son más electronegativos que el oxigeno y se formará el cloruros de oxigeno por ejemplo,, pero... que pasa con las valencias...tendrá el oxigeno EO +2 como con el cloro.... y entonces que EO tendrán los halógenos????
-
Hola, podrían ayudarme hacer el apartado B. Gracias.
Para el tratamiento de acidificación urinaria en niños se administran 75 mg/kg/día de cloruro amónico vía iv en 4 dosis. Disponemos de un frasco de 500 ml de cloruro amónico 1/6M, con PM = 53,5 g/mol.
A) Calcular la dosis total en mg que debe recibir el paciente si pesa 11 kg. B) Calcular el número de gramos de cloruro amónico por ml de solución. C) Calcular el número de ml que debe recibir el paciente cada 6h.
-


David
el 14/10/19Lo siento pero no podemos haceros los deberes en masa, supongo lo entiendes...
Se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-) -
donde ocurre la mayor produccion de CO2 de las ecuaciones balanceadas de fermentación en la glucolisis C6 H12 O6 + 6O2 =6C02 + 6H20
-
El arsenato (AsO4?) es químicamente similar al fosfato
inorgánico (PO4?,) y algunas enzimas que utilizan fosfato
inorgánico pueden utilizar también el arsenato. La producción de
ATP en la glucolisis es inhibida por el arsenato. cierto entonnces cuales son las
enzimas que pueden ser afectadas.
que tenga entendi solo el Gliceraldehido 3 fosfato deshidorgenasa o Las enzima que se ve inhibida es la piruvato deshidrogenasaPDH), el cual cataliza la oxidación de piruvato en acetil-CoA por medio de NAD+. Con la enzima inhibida, la energía del sistema celular se interrumpe resultando en un episodio de apoptosis celular hay alguna otra y la que tengo si es la correcta???


Breaking Vlad
el 15/10/19Hola Felipe Sierra,
lamento comunicarte que esta pregunta se escapa del campo de estudio de la química. Esto deberías postearlo en un foro de biología.
puesto que en esta web no hay, te recomiendo preguntarla aquí: https://www.beunicoos.com/foro/biologia
un saludo,
Vlad
-
hola,¿me podrían ayudar a establecer la reacción redox entre el ascórbico y el permanganato de potasio y el ascórbico y el dicromato de potasio?


Breaking Vlad
el 15/10/19Hola Carmen,
te recomiendo este vídeo: Estados de oxidación en química orgánica
Cuando tengas los estados de oxidación identificados, trata de ver qué grupos se pueden oxidar más, y plantéalos.
Inténtalo y pregúntanos tus dudas.
Un saludo,
Vlad
-
Buenas tardes. En química estudiamos la conducta redox del amoníaco, agregándole a este último hipoclorito de sodio. Con el paso del tiempo aprendo a "deducir" las reacciones y entender que es lo que pasa en ellas y poder predecir los productos que me dan. Sin embargo no puedo entender por que se dan estos productos.
Disculpen si no deje clara la pregunta.


Breaking Vlad
el 15/10/19Hola Lucía, el problema es que la segunda reacción (de la formación de la hidracina) no tiene nada que ver con la oxidación del amoníaco a nitrógeno.
es una reacción de oxidación tal que así:
2OH- + 2NH3 ---> N2H4 + 2H2O + 2e-
Y esta reacción, en combinación con la del cloro es la que da la reacción que te preguntan.
Un saludo,
Vlad
-
Hola, ¿alguien me puede explicar como se hace este ejercicio?:
a) calcula la masa de dióxido de azufre que contiene el mismo número de moléculas que 17.00g de monóxido de carbono
b) ¿en cual de las 2 cantidades hay más átomos?

lucia1902
el 4/10/19A)Tienes que calcular la masa molar del CO y CO2
MM CO= 28 g/mol
MM CO2= 44 g/mol
Después tienes que calcular el número de moléculas de 17g de CO, para eso antes calculamos los moles que contienen 17g de CO
28g______1mol
17g______x=0,28moles
En una mol hay 6,023*1023 moléculas. Entonces:
1 mol _ 6,023*1023moléculas
0,28moles_x=1,68*1023moléculas
Ya sabemos el número de moléculas contenidas en la cantidad que nos dieron de monóxido de carbono. Recordamos de vuelta la igualdad de 1 mol=6,023*1023moléculas y la masa molar de CO2 que era 44g/mol y las relacionamos.
6,023*1023moléculas___________ 44g
1,68*1023moléculas_____________x=12,27 gramos
La masa de CO2 que contiene el mismo número de moléculas que 17g de CO es de 12,27 gramos
B) Con la igualdad de 1mol___6,022*1023átomos te fijas cual tiene más átomos (si es que no es la misma cdd).
-