-
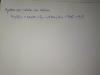
Hola necesito ayuda con este ejercicio, concretamente el problema que tengo es que no se en que influye el paso de la reacción por el tubo
Gracias de antemano


Jerónimo
el 20/6/19Recuerda que el porcentaje en volumen coincide con el número de moles .Si consideramos como base de cálculo 100 moles, tendremos inicialmente 20 moles de CO y 80 moles de Ne
FeO+ CO-------->Fe +CO2
20 -
x 20-x Kp=PCO2/PCO= Ptotal x XCO2 /Ptotalx XCO =nCO2/nCO
0,403=(20-x)/x x=5,74 moles de CO 20-5,74=14,26 moles de CO2 80 moles de Ne al ser un gas inerte
-
se decide establecer una nueva escala de temperatura en la que el punto de fusión del amoniaco (-77,75°c) es 0°A y el punto de ebullición del amoniaco (-33,35°c) es 100°A ¿Cual seria el punto de ebullición del agua en °A y la temperatura del cero absoluto en °A
-
Porque el KCl es insoluble en etanol?
-
NH3(ac) + H2O(l) <====> NH4+(ac) + OH-(ac) Kb= 1.8x10-5
Co-x x x
Kb=x*x/(Co-x) =1.8x10-5
pH + pOH = 14 => pOH = 14 - pH = 14 - 11.55 = 2.45 => (OH-) = 10 elevada(-2.45) = 3.55x10-3 M
(3.55x10-3)*(3.55x10-3) = (1.8x10-5)*(Co-3.55x10-3) = 1.8x10-5Co - 6.39x10-8 = 1.26x10-5
Co=(1.26x10-5+6.39x10-8)/1.8x10-5 = 0.70 M
(0.70molNH3/L)*0.625L*(17gNH3/1molNH3)*(100%/6.8%)*(1ml/0.97gNH3) = 112.75 ml
Mi procedimiento es correcto?
-
Calcular el pH de las siguientes soluciones: a) NaCH3CO2 (aq) 0.63 M; b) NH4Cl (aq) 0,19 M
Datos: Ka (CH3CO2H) = 1.8 · 10-5; Kb (NH3) = 1.8 · 10-5
AYudaaaa


Breaking Vlad
el 17/6/19Te recomiendo este vídeo:
Se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis siempre también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro.
-


Breaking Vlad
el 17/6/19Hola Carmela,
el ejercicio b) está correcto.
El c) se explica mediante el siguiente contenido:
Descenso crioscópico - Propiedades coligativas - Punto de congelación
Un saludo,
Breaking Vlad
-
-
Hola buenas tardes,
Ojalá alguien me pueda echar una mano con este problema que no me sale...
Se me ocurre hacer la recta con los datos del pireno y el área pico, pero luego no se muy bien por donde tirar...
Un saludo y gracias!