-
Hola Unicoos
Cómo sé cuándo es más electronegativo el H ?
Creo que tiene que hay que compararlo con los grupos de los no metales y con los térreos no es más electronegativo. Alguien me dice cómo lo puedo saber?
Por ejemplo al hacer el dibujo de la polaridad, necesito poner las flechas del más al menos electronegativo. No sé diferenciar si H con C es más electronegativo H o si H con Si es más electronegativo H o Si.
Muchas gracias
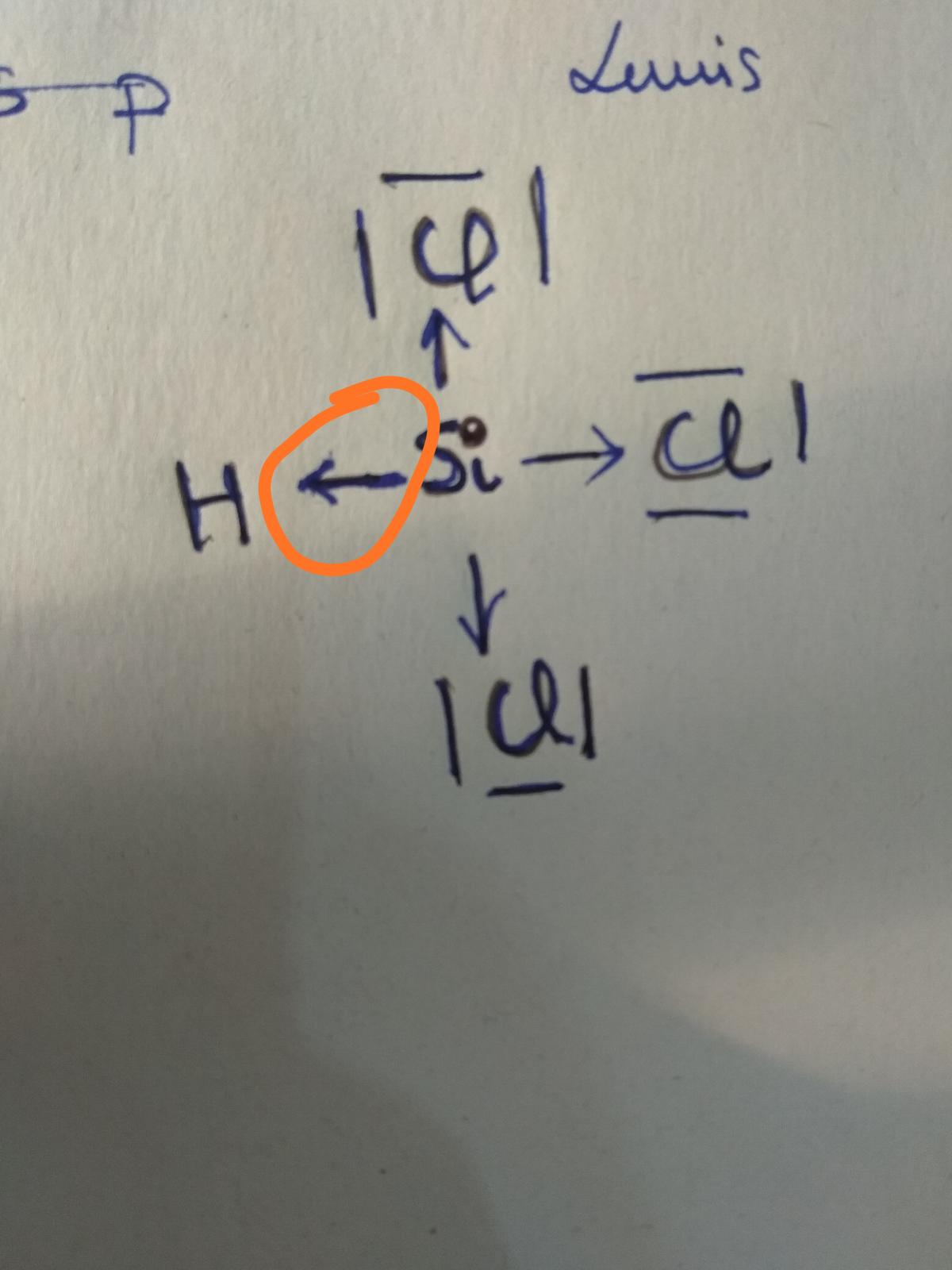
-
-
Hola, alguien podría ayudarme con este problema? he sacado los moles de cada gas, pero no se como continuar, gracias
-
Hola, les comento mi duda a ver si me pudiesen ayudar. Entiendo el concepto de energía de ionización y se razonar como y por que varía según avancemos en un grupo o periodo. Pero me he encontrado con un ejercicio en que me dan los kJ/mol de la primera y segunda energía de ionizacion y me piden que razone en que grupo se encuentra el elemento. No me dan mas info, ¿es posible saber cual es sin tener ninguna tabla de datos?? Gracias de antemano chicos.






























