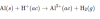-




Jerónimo
el 31/5/19Tienes un fallo en la masa molar del HCl, has puesto 35,5 y es 36,5
Otro fallo es el cálculo del agua que hay en la disolución. A 1200g de disolución tienes que restarle 444 g de soluto, serán 756g que serán 0,756 Kg de agua .Este valor debe ir en la fórmula de la molalidad.
b) 2x12,5=200xM M=0,125 moles/l
-
Hola, alguien podría indicarme: ¿Por qué los ladrillos refractarios soportan más calor (no se descomponen o funden) que los vidrios usado en las ventanas, si ambos están constituidos, en su mayoría, por óxidos básicos?
-
alguien me podría ayudar con este problema? lo he resuelto pero no estoy segura de si esta bien
en la etiqueta de un frasco de HCL dice: riqueza 37 por ciento en peso y densidad 1,2 g/cm cúbicos. calcula la molaridad, la molalidad y la fracción molar del acido. B) tomamos 2 ml de ese ácido y se mezcla con agua pura para formar 200 ml de disolución. calcula la molaridad de la disolución resultante. datos: m (hcl) 35,5 y densidad del agua 1g/cm cubicos
-
-
-


Jerónimo
el 28/5/19En total 8 electrones, los correspondientes al 2p , 3p, 3d y 4p
Configuración electrónica y números cuánticos. Moeller AUFBAU
-


Jerónimo
el 28/5/191,85g /ml x 100ml x 42g/100g =77,7 g HNO3 moles HNO3=77,7/63=1,23 moles
g de agua=854-77,7=776,3 g moles agua= 776,3/18 =43,12 moles Xs=1,23/(1,23+43,12)= 0,028
¿Qué es la concentración en química?