-
un compuesto binario de cinc y azufre contiene un 67,1% de cinc en masa.
¿cual es la relación de los átomos de zinc y azufre en el compuesto?


Breaking Vlad
el 1/5/19Hola Jasson,
Desde unicoos no tratamos de resolver vuestros ejercicios sino de resolveros las dudas concretas que os hayan salido durante el proceso.
Te recomiendo ver este vídeo:
Fórmula empírica y composición centesimal
intentarlo, y con las dudas que tengas, nos preguntas.
Un saludo,
Breaking Vlad
-
Calculate the energy in the form of heat (in kJ) required to convert 325 grams of liquid water at 20.0 C to steam at115C. Assume that no energy in the form of heat is transferred to the environment. (Heat of fusion = 333J/g; heat of vaporization = 2256 J/g; specific heat capacities: liquid water = 4.184 J/gK, steam = 1.92 J/g
Sé que está en ingles, pero de verdad necesito saber qué estoy haciendo mal.
esto es lo que hice...
Q=mcT
Q = 325 ( 4.184) (100 - 20)
= 325 ( 4.184 ) ( 80)
= 108784 JQ= ml
Q= 325 ( 2256)
= 733200 J
Q = 325 (1.92) ( 115 - 100)
=325 (1.92) ( 15)
= 9360 J108784+733200+9360= 851kJ
Pero la respuesta correcta es 735 kJ
Alguien sabe en qué me equivoqué? -
a) si la masa promedio de un solo átomo de hidrógeno es de 1.6*10^-24g
¿cual es la masa en gramos de 6.02*10^23 átomos de oxigeno? ¿como se compara su respuesta, numéricamente, con lamasa atómica del hidrógeno?
b) si la masa promedio de un solo átomo de oxigeno es de 26.558*10^-24g.
¿cual es masa, en gramos, de 6.02*10^23atomos de oxigeno? ¿como se compara, en cuanto al numero, esta respuesta con la masa atómica del oxigeno
-
la altura de un caballo por lo general se mide en palmos y no en pies. si 1 palmo es igual a 1/3 pie(exactamente)
a)¿cual es la altura( en centímetros) de un caballo que mide 18.6 palmos?
b) ¿cual es el volumen (en metros cúbicos) de una caja que mide 6*2.5*15 palmos?
-
El volumen de agua usado para irrigar cultivos se mide en acre-pie ; un acre-pie es la cantidad de agua con profundidad de 1 pie necesaria para cubrir un acre de tierra
A)¿Si una milla cuadrada hay 640 acres ¿cuantos pies cúbicos de agua hay en 1 acre-pie?
b)¿cuantos acre-pie hay en el lago Erie (volumen total 166mi^3)


Breaking Vlad
el 1/5/19Hola Jasson,
este ejercicio no corresponde con el temario de química directamente. Yo te recomendaría postearlo en física, o incluso matemáticas, al tratarse de cambios de unidades.
Necesitas saber cuantos pies son un acre, y en función de eso podrás calcular lo que te piden.
Un saludo,
Breaking Vlad
-
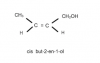
Hola Unicoos, me dicen en un ejercicio:
Realiza el isómero cis de un alcohol primario de cuatro carbonos.
Tengo dos dudas:
1) Qué quiere decir un alcohol primario? significa que tiene enlaces simples? no sé que es. Existen alcoholes secundarios? qué serían ?
2) Y sólo sé hacer isómeros cis y trans con dobles enlaces, es decir con una insaturación, entonces en este caso, la pondría donde quisiera al no especificar?
Muchas gracias
-
Hola,no se muy bien como hacer esta actividad,¿ podrían ayudarme?
Calcular los gramos de sal y de agua producidos al hacer reaccionar 150 g de ácido sulfúrico,con 100 g de hidróxido berílico.


Breaking Vlad
el 30/4/19Hola Daniela,
has de plantear la reacción:
H2SO4 + Be(OH)2 -> BeSO4 + 2H2O
después con las masas moleculares calculas los moles de cada compuesto, y miras cual es el limitante. Una vez con eso podrás calcular los moles, y los gramos de sal y agua.
Espero haberte ayudado,
un saludo,
Breaking Vlad
-
Y las concentraciones en el equilibrio son los moles , despejando 0,082 x273 kx0,6 atmósfera y 1L .despekando sería los moles la concentración . Las concentraciones en el equilibrio