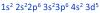-
Algun sitio donde pueda aprender formulacion organica??? La iupac ha cambiado asique los videos de unicoos ya no me sirven pq son de hace 7 años


Breaking Vlad
el 21/3/19Hola Antonio,
por lo que he podido ver, a grandes rasgos no hay muchas diferencias, para la gran mayoría de la formulación puedes ver estos:
Formulación orgánicay si no te ayudan puedes ver estos:
https://www.youtube.com/playlist?list=PLJ1OaZOKtc5aK3kmK8b2GrwND2F7pBaI0
un saludo,
Breaking Vlad
-
-
Hola
Me dice el enunciado que calculé la masa de 12,1023 moléculas de agua y no sé cómo hacerlo


Breaking Vlad
el 20/3/19Hola Víctor,
has de calcular el número de moles de agua usando el número de avogadro:
Y acto seguido calcular el peso utilizando la masa molecular:
Masa atómica, molecular y molar
Un saludo,
Breaking Vlad
-
Hola Unicoos
Me pueden ayudar en el siguiente ejercicio:
Calcula la concentración de masa de una disolución formada por 52g de azúcar y 1l de aceite
-
 4,5 y 8 no terminan de salirme.
4,5 y 8 no terminan de salirme. 

Jerónimo
el 19/3/19Para el 4 y 5 tienes este vídeo Disoluciones 01
8) 6,25 m significa que hay 6,25 moles en 1000g de agua
6,25 moles NaOH x 40g/1mol=250g de soluto NaOH
En total tenemos 1250 g de disolución. 1250g disolución x 1ml/1,25g =1000ml=1 litro
M=6,25 mol/l
250g/l
% en masa=250/1250 x100=20%
-


Breaking Vlad
el 19/3/19Hola Bet,
Ese enunciado a mi parecer está mal planteado. Deberían especificarte sobre qué electrón te están preguntando. En esa configuración completa tienes 25 electrones, cada uno con sus números principal y secundario, si bien lo común es que te pregunten por el último, es algo que se debería especificar.
Te dejo el enlace al vídeo en el que se explica sobre este tema:
Un saludo,
Breaking Vlad
-
Hola, alguien me podría explicar como se calcula la concentración de actividad mediante este ejercicio? es un tema que todavía no vimos, pero me gustaría empezar a estudiarlo. Muchas gracias!
Usted tiene un vial con 10 ml de solución conteniendo 100 mCi de 99mTc a las 8 de la mañana. ¿Qué sucederá con la CA de dicha solución en los siguientes casos?
a) Agrega 10 ml de agua.
b) Agrega 10 mg de bicarbonato de sodio.
c) Espera 6 horas.
d) Utiliza 5 ml de la solución.
e) Agrega 10 ml de otra solución conteniendo también 100 mCi de 99mTc.


Breaking Vlad
el 19/3/19Hola Lucas,
sentimos comunicarte que estas dudas se escapan del contenido de unicoos, desde la plataforma contestamos dudas que tengan que ver exclusivamente con los vídeos que se contienen en ella.
Si algún alumno sabe del tema y se anima a contestar, sería ideal.
Un saludo,
Breaking Vlad
-
Buenas, la constante de equilibrio sé que depende de la temperatura, pero, ¿depende de las condiciones iniciales (concentración inicial, números de moles,...)?. Y, una pregunta, ya por curiosidad científica, si conozco la constante de equilibrio a una cierta temperatura (por ejemplo, el producto iónico del agua a 298K) la puedo conocer a cualquier otra temperatura?


Jerónimo
el 18/3/19Solo depende de la T y la ec de Vant Hoff es la que relaciona las ctes de equilibrio con la T
Equilibrio y temperatura. Ecuación de Van't Hoff -
Hola Unicoos
¿Es correcto indicar qué geometría tiene la molécula en hibridación?
Y para poner qué geometría tiene, ¿me baso en el diagrama de Lewis o en la TRPECV ?
Muchas gracias


Jerónimo
el 18/3/19Es correcto ya que la hibridación intenta explica la geometría molecular y el comportamiento de algunas moléculas .
Respecto a la segunda pregunta, decirte que las estructuras de Lewis nos dan información de como están unidos los átomos pero no de como están distribuidos espacialmente dichos enlaces, y para determinar la geometría molecular usamos entre otras cosas la hibridación o la TRPECV