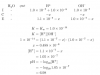-
-
Buenas tardes,
Tengo dudas sobre si he utilizado bien la ecuación de arrhenius para desarrollar este ejercicio. Me podrían ayudar,
Gracias de antemano.
Saludos
-


Jerónimo
el 9/2/19nI2=10/253,8=0,039 nIH=10/128=0,078
H2 + I2←-----------------→2HI
-- 0,039 0,078
+x +x -2x
+x 0,039 +x 0,078-2x 1,6=(0,078-2x)²/[x(0,039+x)] Operando 2,4x²-0,3744x+6.10-3=0
Resolviendo x=0,018 moles
nH2=0,018 g H2=0,018*2=0,036 g
nI2=0,057 g I2=0,057*253,8=14,46 g
nHI=0,042 g HI=0,042*128=5,36 g
-
Me podéis ayudar con este?
Calcular el peso de sulfato de magnesio heptahidratado, MgSO 4 .7 H 2 O, que debe
añadirse a 1 000 g de agua para para obtener una disolución al 15% de sulfato anhidro


Daniel Chicana Zapata
el 9/2/19Hola Marta
En el tema de disoluciones ten cuenta esta fórmula imprescindible : mo + me =mn
y esta también: x%= (mo/mn)*(100%)
Donde:
mo=masa del soluto
me=masa del solvente
mn=masa de la solución
1) Del dato: disolución al 15% de sulfato anhidro
15% = (mo/mn)*(100%)
15% = (mo/mo+me)*(100%)
15%= (mo/mo+1000g)*(100%)
0.15=(mo/mo+1000g)
mo=176.471 g
-


Jerónimo
el 9/2/19Tienes que relacionar la presión de vapor con la temperatura.
La temperatura para la cual la presión de vapor de un líquido iguala a la presión externa se denomina punto de ebullición del líquido
Un líquido hierve a aquella temperatura en que la presión de su vapor es igual a la atmosférica. En consecuencia, un aumento de presión exterior trae consigo una elevación del punto de ebullición.
Con estas premisas ya puedes razonar las respuestas