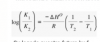-
Buenas tengo una duda sobre la formula de linealizada de Arrhenius, tengo que resolver un ejercicio en el cual tengo que buscar la Ea y encuentro dos fórmulas que me crean dudas.
cual es la correcta? y si las dos son correctas cuando usar una u otra?
Gracias de antemano,
Saludos,


Breaking Vlad
el 8/2/19Hola Joshua,
quizás te ayude este vídeo a entender la diferencia entre ambas ecuaciones:
https://youtu.be/0Z0-VQKUZFsUn saludo,
Breaking Vlad
-
Buenas, necesito ayuda con la siguiente actividad: La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12 H22O11.
Se tiene un paquete de 150g de azúcar. Calcula razonadamente:
a) El número de moles de azúcar que se tiene en el paquete.
b) El número de moléculas de azúcar que se tiene en el paquete.
c) El número de átomos de carbono, hidrógeno y oxígeno que se tienen en el paquete.
(Masas atómica: C=12uma, H=1uma, O=16uma) (Redondear a tres cifras decimales los resultados)
-
Hola buenas necesito ayuda con este problema:
Se necesita preparar 300mL de una disolución 0,6M.Calcula qué cantidad de soluto necesitas si dispones de un producto de ácido sulfúrico del 26% de riqueza y una densidad de 1,19 g/mL
Mucha gracias!


Breaking Vlad
el 7/2/19Hola Alberto,
te recomiendo este vídeo:
una vez lo hayas intentado, coméntanos las dudas concretas que te hayan surgido. El trabajo duro debe ser el vuestro, nosotros ayudamos.
Un saludo,
Breaking Vlad


Jerónimo
el 7/2/19Tienes correcto el cálculo de los gramos que necesitas pero la segunda parte la tienes mal. Los 17,64 g debemos sacarlos de la disolución comercial de d=1,19g/ml y 26% de riqueza.
1ml/1,19gdisolución x 100gdisolución/26gsoluto x 17,64 g soluto = 57,8 ml hay que tomar de la disolución comercial y completar con agua hasta 300ml
-
Hola buenas. ¿ Alguien me pude ayudar con el siguiente problema ?
Calcula la concentraciom en g/l, en % en volumen, y en % en masa, de una dicolucion obtenida al disolver en 1200 ml de agua 650g de hidroxido de calcio, daniendo que la densodad de la disolucion resultante es de 1,3 g/l
muchas gracias
-
A ver una duda tonta. En formulación inorgánica me encuentro con el compuesto Dibromuro de pentaoxígeno, que a mí de toda la vida me enseñaron a formular como pentaóxido de dibromo. La nomenclatura en stock del O5Br2, cómo sería. Mil gracias
-
Necesito ayuda para estas preguntas, me entran en el examen y no se hacerlas.
Explica los tipos de estereoisomería que se pueden encontrar en el 2,3-dicloro-2-buteno, benceno, 3metilhexano, 3-hexeno y en el 2 butanol, formualndo los posibles estereoisómeros existentes para cada compuesto.
Escribe la fórmula desaroolada y un isómero de función para el etil.metil-éter
Escribe la fórmula desaroolada y un isómero de cadena 2,4,5-trimetil-nonano
Escribe la fórmula desaroolada y un isómero de posición, uno de cada cadena y uno de función del 3 - heptanol
-
Hola, tengo problemas para resolver este ejercicio, si alguien por favor me lo puede explicar se lo agradecería mucho.
*Un balon 7.5 L contiene gas a 750 torr y 25°C, y está conectado mediante una válvula a otro recipiente vacío. Se abre la válvula y, una vez realizada la expansión isotérmica, se observa que la presión final es de 500 torr.
a) Calcule el volumén del recipiente vacío
b) Si el gas era una mezcla de 1.1 gr de N2 y una cantidad desconocida de Ar ¿Cuáles eran las preciones parciales de cada gas en el balón antes de abrir la válvula?
-
Hola.. tengo dos preguntitas...
1. Si los anhidridos son una combinación de oxígeno y no metal. Por qué hay anhidridos de manganeso y otros metales.?
2. Para formar compuestos metálicos y no metálicos, se deben usar los metaloides? o cómo es??


Breaking Vlad
el 5/2/19Hola rob9p
un anhídrido es un oxoácido al que se le ha quitado el agua (de ahí lo de anhídrido) el SO3 sería el anhídrido sulfúrico porque viene del ácido sulfúrico H2SO4 si le quitas agua (H2O) te queda SO3. De modo que mientras exista el oxoácido, existirá el anhídrido.
y la pregunta 2 no sé si la llego a entender. Los enlaces metálicos se forman entre metales y algunos metaloides. y los no metálicos entre los no metales y algunos metaloides. Es decir, los metaloides pueden dar tanto metálicos como no metálicos.
Espero haber aclarado tus dudas,
un saludo,
Breaking Vlad