-
Necesito ayuda con la siguiente pregunta:
Prescindiendo de los coeficientes de actividad y sabiendo que la constante de disociación del ácido láctico es Ka= 1,38·10-4 , calcúlese el grado de hidrólisis y el pH de una disolución 0,09 molar de lactato sódico.


Jerónimo
el 12/1/19ANa ----------→ A- +Na+ He llamado A- al anión lactato. A- sufre hidrólisis porque procede del ácido láctico que es un ácido débil y Na+ no sufre hidrólisis porque procede de una base fuerte NaOH
A- +H2O ←--→AH+OH_
0,09 -- --
-x x x
0,09-x x x Kh=Kw/Ka= 1.10-14/1,38.10-4=7,24.10-11 7,24.10-11=x2/(0.09-x) 0,09-x≅0,09
[OH]= x=√7,24.10-11 *0,09=2,52.10-6 M pOH=5,59 pH=8,41
Hidrólisis - Valoración ácido debil base fuerte -
Una duda de estructuras de lewis.
¿Por que en la estructura del CO la C tiene (2+) y en la estructura de NO la N tiene (-)?
En el caso de CO el oxigeno está completo y al carbono le faltan 2e- y el segundo caso el Nitrogeno le falta 1e- Pero no entiendo el signo + y -
Saludos


Jerónimo
el 12/1/19En el caso del NO hay una estructura resonante donde al N se le asignan 6 electrones y como el N tiene 5 e- de valencia, se le coloca una carga formal de -1.
En la estructura de Lewis del CO, al C se le asignan 5 electrones y como tiene 4 e- de valencia, su carga formal será -1. Al átomo de oxígeno en esta misma molécula se le asignan 5 e- y como tiene 6- de valencia , su carga formal será +1.


Juan
el 12/1/19Según el vídeo que adjunto de Unicoos no representa el co de esa forma, puedes comprobarlo en el minuto 13:30 aprox: ¿Cual es la forma correcta? Si me pudieras poner un dibujo de ello te lo agradezco. Gracias por tu tiempo.
Enlace covalente Estructura de LEWIS -
Hola me he atascado en este ejercicio me podriais echar una mano . Gracias.
Se introduce una muestra de 0,0240 mol de N2O4(g) en un matraz vacío de 0,372 L y se
deja que alcance el equilibrio con NO2(g) a 25 grados
C. Calcule la cantidad de N2O4 presente en el
equilibrio, sabiendo que a esa temperatura la constante de equilibrio vale: Kc=4,61x10-3
-
Con respecto a mi pregunta anterior de como calcular el Pb total de una planta en base a la concentración de cada tejido, ¿los cálculos serían así?:
Valores de ug por g de Pb: raíz 21.6, tallo 7.2 y hoja 12.6
Peso total: raíz 2.38g, tallo 2.21g y 1.94g
ug de Pb por el total de masa por tejido: raíz 51.41, tallo 15.9 y hoja 24.4
Hago la sumatoria de estas 3 y tengo en planta 91.76 ug Pb. Tomando en cuenta lo que me respondieron anteriormente 91.76 lo divido entre el peso total de la planta que es 6.53 por lo que LA CONCENTRACIÓN TOTAL SERÍA 14.1 ug de Pb. En caso de ser así lo que no entiendo es por que si estamos hablando de concentraciones totales por tejido y esto se suma ¿por que hay que dividirlo entre la masa total de la planta? ¿por que la sumatoria no podría ser la concentración total?
Ojalá alguien pueda ayudarme, saludos


Jerónimo
el 11/1/19Cuando haces el sumatorio del Pb obtienes 91,76 μg de Pb, pero eso NO es una concentración.
Para obtener la concentración de Pb en la planta , divides entre la masa total de la planta y el resultado SI que es una concentración, pero no puedes expresarlo como 14,1μg de Pb, lo correcto sería 14,1μg de Pb /g de planta.
-
Tengo una duda sobre como escribir las semirreacciones con respecto al Fe:
Fe+2 = (2Fe)+3 + 6e-
Para el Bromo seria asi
6e- +6H+ + 3HBrO = 3HBr + 3H2O
Entones
2FeSO4 6H+ + 3HBrO = 3HBr + 3H2O + Fe2(SO4)3
Pero el H2SO4 no se como agregarlo a la ecuación para que quede bien balanceada me gustaria que me dijeran paso a paso que e slo que debo hacer para entenderlo bien.


Breaking Vlad
el 11/1/19Vale, vamos por partes.
Las semirreacciones que tienes escritas no son correctas.
Para el Fe sería:
Fe2+ -> Fe3+ + e-
Para el HBrO sería:
2H+ + BrO- +2e- -> Br- + H2O (básicamente tú tienes el equivalente, pero todo multiplicado por 3)
Y una vez sumes eso de modo que se cancelen los electrones, tendrás la reacción iónica ajustada, y entonces añades los H2SO4 en lugar de los H+ y lo ajustas.
Un saludo,
Breaking Vlad


Jerónimo
el 11/1/19FeSO4+HBrO+H2SO4--------------→Fe2(SO4)3+HBr+H2O
2e- + 2H+ +BrO- -----------------→Br- + H2O
2Fe+2--------------------------------→2Fe+3 + 2e-
-----------------------------------------------------------
2H+ BrO- +2Fe+2 --------------→ Br- +H2O +2Fe+3
2FeSO4+1HBrO+1H2SO4--------------→1Fe2(SO4)3+1HBr+1H2O
-
Buenas noches,
He leído que el cloruro de sodio no se puede considerar una molécula porque cada ion de sodio está rodeado por 6 cloruros. El simple hecho de que haya átomos de sodio y átomos de cloro no le hace una molécula?


Jerónimo
el 10/1/19Repásate el enlace iónico.
El Enlace IónicoLos compuestos iónicos no forman moléculas sino redes cristalinas que cristalizan en diferentes sistemas (cúbicos, centrado en las caras,etc)
-
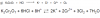 me pidieron balancear esta ecuación en un medio ácido pero no se como agregar el Cl- lo único que se me ocurre es hacerlo de la siguiente manera:
me pidieron balancear esta ecuación en un medio ácido pero no se como agregar el Cl- lo único que se me ocurre es hacerlo de la siguiente manera:K2Cr2O7 + 7HCl + 7H+ = 2K+2 + 2Cr+3 + 3Cl2 + 7H2O
Me gustaria que me dijeran si esta correcto y sino cual es el método correcto de hacerlo.


Jerónimo
el 11/1/19K2Cr2O7 +HCl----------→KCl+CrCl3+Cl2+H2O (El Cr+3 y Cl- en forma molecular será CrCl3)
6e- +14H+Cr2O7-2---------→2Cr+3 +7H2O
(2Cl- --------→Cl2 +2e-) x3
---------------------------------------------------------------
14H+ + Cr2O7-2 + 6Cl- -----→ 2Cr+3 +7H2O+ 3Cl2
K2Cr2O7 + 14HCl------------→2KCl + 2CrCl3 + 3Cl2 +7H2O
-
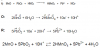 Me pidieron balancear esta Ecuación en un medio ácido y si bien logré hacerlo no se como agregar el HNO3 y el NO3- en la ecuación pues si pongo el 10 de los H+ en el HNO3 se desequilibran las cargas por lo que lo único que se me ocurre es dejar la ecuación de esta forma:
Me pidieron balancear esta Ecuación en un medio ácido y si bien logré hacerlo no se como agregar el HNO3 y el NO3- en la ecuación pues si pongo el 10 de los H+ en el HNO3 se desequilibran las cargas por lo que lo único que se me ocurre es dejar la ecuación de esta forma:2MnO + 5PbO2 + 9H+ + HNO3 = 5Pb+2 +2 HMnO4 + 4H2O + NO3-
Pero no se si esta bueno o si es la forma correcta me gustaría de su ayuda.



















