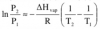-


Jerónimo
el 16/1/19Qué es la concentración en química?
Riqueza o tanto por ciento en masa
1,05g/cm3 x 500cm3=525g de disolución
525x5/100=26,25 g
%en masa=20/220 x100=9,09%
220g x 1ml/1,09g =201,83 ml=0,202 l
20g/0,202l = 99 g/l
-
1. Si a 0,500 litros de disolución 0,010 M de AgNO3 se añaden 0,08 moles de ácido acético, ¿precipitará el acetato de plata? Kps(AgOAc)=2,30x10-13; Ka(HOAc)=1,8x10-5
2. ¿Cuál es la solubilidad del yoduro de plomo (II) en una disolución de yoduro de potasio 0,10M? Kps yoduro de plomo (II) = 7,1·10-9
ayuda con estos también por favor???
gracias de antemano


Jerónimo
el 16/1/191) Precipitará si [Ag+][CH3COO-] es mayor que su Kps. .
El AgNO3 es una sal soluble y está totalmente disociada, aportando a la disolución todos los cationes Ag+.
En cambio , el ácido acético es un ácido débil y tienes que hacer el equilibrio utilizando la K de acidez para ver cuanto acetato se ha disociado.
2) PbI2(s) ←--------→ Pb*2+ 2I- KI es sal soluble totalmente disociada aportando 0,1 M de I-
S 2S Kps=[Pb+2] [I-]2=S (2S+0,1)2 0,1 es mucho mayor que 2s 7,1.10-9= S (0,1)2 y despejas S
-
Buenos días!
Podría alguien ayudarme con este ejercicio, por favor: La Kps del cloruro de plata es de 2,0x10-10 . Calcular los gramos de cloruro de sodio que se precisa añadir a 100 ml de una disolución 0,010M de AgNO3 para que se inicie la precipitación.
En los vídeos no he visto que haya planteado nada similar. Muchas gracias :)
-
La energía interna de una sustancia sólida es igual a:
a) La energía mecánica total de sus moléculas
b) La energía potencial de sus moléculas
c) La energía cinética total de sus moléculas
d) La energía mecánica media de sus moléculas
e) La energía cinética media de sus moléculas


Breaking Vlad
el 16/1/19Hola Álvaro,
se trata de que nos planteéis vuestras dudas concretas, no de que resolvamos vuestros ejercicios.
Te recomiendo este vídeo: https://www.youtube.com/watch?v=qG_brwwX32A
Un saludo,
Breaking Vlad
-
No sé por dónde empezar , ¿puedo utilizar la ecuación de Antoine: lnP= -A 1/T +B ¿siendo B el punto de ebullición? o está ecuación no tiene nada que ver en este ejercicio
La presión de vapor del triclorometano (cloroformo), es 40,0 torr a -7,1ºC. La entalpía de vaporización es 29,2 kJ/mol. Calcule el punto de ebullición normal.
-
Se hace reaccionar dióxido de manganeso y ácido clorhídrico para obtener gas cloro según la reacción: MnO2 (s) + HCl (ac) → MnCl2 (s) + H2O (g) + Cl2 (g)
Determine: a) La cantidad en gramos de MnO2 necesaria para obtener 100 L de Cl2 a 20o C y 1 atm.
b) El volumen de ácido clorhídrico 5 M necesario.
Masas atómicas: M(Mn) = 54,9; M(O) = 16,0. R = 0,082 atm l mol-1 K-1
-
falso o verdadero?
a) Una molécula en la que todos los enlaces son iguales será apolar.
b) La estructura del metano es tetraédrica como consecuencia de la hibridación sp3 sufrida por el carbono.
c) Los enlaces de hidrógeno presentes son la causa de que la densidad del agua sólida sea inferior a la del agua líquida a 0o C.
-
Buenas! Quería preguntar si alguien sabe como aumentar y disminuir la solubilidad de un producto?
Muchas gracias :)
-
Necesito ayuda con el apartado c.
A 760 mm Hg de presión una mezcla de acetona y tolueno hierve a 80 ºC. A esta temperatura
las presiónes de vapor de estas sustancias son 1610 y 290 mm Hg respectivamente. Calcular:
a) La composición de la disolución. Sol: Xacetona = 0,356; Xtolueno = 0,644
b) La composición del vapor en equilibrio con la disolución anterior. Sol: Xacetona = 0,754; Xtolueno
= 0,246
c) Si condensamos el vapor del apartado b), ¿cuál será la presión de vapor del líquido obtenido?
No entiendo como hacer el proceso de evaporación para calcular la presión de vapor del liquido.
Gracias por vuestro tiempo.
-
No se como empezar con este ejercicio.
¿Cuántos gramos de glucosa, C6H12O6 deben disolverse en 500mL de agua a 25ºC, para que la presión de vapor de la disolución resultante tenga un valor de 148,9 torr a 60ºC? Sol:16g DATOS: Densidad del agua (25ºC)= 0.9971g/cm3 ; P0 agua (60ºC)= 149.38 torr.
Mi problema es que no se como resolver este ejercicio con el cambio de temperatura.
Gracias por vuestro tiempo.