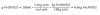-
Buenas, ¿alguien me puede ayudar con este ejercicio?: Balance energético de la beta-oxidación completa hasta ATP, CO2 y H2O del ácido graso mirístico.
En todos los ejemplos que veo por internet solo hablan del ATP pero no del CO2 y H2O.
Muchas gracias de antemano.


Breaking Vlad
el 14/11/19Hola Lorena,
esta duda se escapa del contenido de la asignatura de química. Te recomendaría postearla en el foro de biología de www.beunicoos.com
Un saludo,
Vlad
-
Hola tengo una duda con el ejercicio numero 2, la respuesta no deberia ser un 50% si se tiene la misma cantidad de cada uno??
-
-
Buenos días disculpen pero no sé mucho de química pero me gustaría saber si me pueden ayudar a saber la fórmula química si es que existe de los siguientes elementos
Y+O+Se+Li+N+Ne
Itrio+oxígeno+selenio+litio+nitrógeno+neón
En ese orden en espesifico
-
me podeis ayudar con este problema porfavor ?
Hacemos pasar 100 cm3 de H2S, medidos a 20oC y 1 atm, a través de una disolución que contiene exceso de CuCl2, formándose CuS y HCl. Determina la masa de CuS que se formará Datos: Masas atómicas: S = 32; Cu = 63,5


Breaking Vlad
el 6/11/19se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)