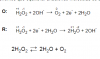-
H2O2 + Cl2O3 + Ba(OH)2 = Ba(ClO2)2 + H2O + O2
Llevo un rato intentando balancear esta ecuación pero me queda de esta forma:
Al agregarla a la ecuación original me queda
2H2O2 + Cl2O3 + Ba(OH)2 = Ba(ClO2)2 + 2H2O + O2
y entonces tengo los O e H desbalanceado, me gustaria que me dijeran que debo hacer
-
He empezado hoy con estequiometría y me han mandado algunos ejercicios. En todos ellos no he tenido ninguna dificultad excepto con este, porque no se por donde empezar ni como hacerlo.
Me puede ayudar alguien?


Jerónimo
el 18/1/19Moles de átomos y moléculas Moles y número de Avogadro
No es estequiometría, es un problema de cantidad de sustancia , moles , número de Avogadro...
6.10^25 átomos x 1 molécula/3 átomos=2.10^25 moléculas de agua
2.10^25 moléculas x1mol/6,02^23 moléculas = 33,2 moles
6.10^25 átomos x 2 átomos de H/3 átomos = 4x10^25 átomos de H
33,2 moles x 18g/ 1mol=597, 6 g de H2O
-
Hola, tengo una duda en Termodinámica. ¿Cómo sé cuando tengo que usar la Ley de Hess o la fórmula de la variación de la entalpía (la suma de los moles de los productos menos la suma de los moles de los reactivos)? Hay en algunos ejercicios que uso dicha fórmula cuando en realidad debería haber utilizado la Ley de Hess y me da exactamente el mismo resultado
Gracias
-
alguien que tenga claro como hacer el analisis del DQO , podria acordarme como termina ? es que realice el analisis hace mucho tiempo y lo ultimo que recuerdo es colocar la muestra en el fotometro junto con el blanco , y esto daba una cantidad de demanda de oxigeno y recuerdo que dependiendo ese resultado se le agregaba cierta cantidad de algo y se dejaba por 1 dia mas o menos , en el cuaderno tengo como resultado 0.8 finalizados 5 dias ...alguien podria decirle que se le agrega a la muestra ? y esos 0.8 que son y por ultimo si esa la prueba del DBO es completamente aparte o tiene algo que ver con la del DQO
-
 tengo una duda sobre qué configuración electrónica sacar pues en todos esta el N y H pero o se si para cada compuesto debo agregarle o quitarle electrones para hacerles la configuración electrónica adecuada.
tengo una duda sobre qué configuración electrónica sacar pues en todos esta el N y H pero o se si para cada compuesto debo agregarle o quitarle electrones para hacerles la configuración electrónica adecuada.

Breaking Vlad
el 18/1/19Hola Daniel,
una cosa es la configuración electrónica y otra diferente es lo que pasa con la molécula al final.
Combinando N e H (cada uno con sus configuraciones) darán diferentes moléculas.
Y una vez que tengas las moléculas ya se le añaden o quitan electrones a todo el conjunto.
Por lo que la configuración electrónica es solo para cada átomo.
Un saludo,
Breaking Vlad